Западение уступчивых мест грудной клетки. Респираторный дистресс-синдром плода и новорожденного: когда первый вздох дается с трудом
URL
I. ОСОБЕННОСТИ ПАТОГЕНЕЗАРеспираторный дистресс-синдром является наиболее встречающимся патологическим состоянием у новорожденных в раннем неонатальном периоде. Встречаемость его тем выше, чем меньше гестационный возраст и чем чаще возникают патологические состояния, связанные с патологией систем дыхания, кровообращения и ЦНС. Заболевание полиэтиологично.
В основе патогенеза РДСН лежит дефицит или незрелость сурфактанта, что приводит к диффузному ателектазированию. Это, в свою очередь, способствует снижению легочного комплайнса, увеличению работы дыхания, усилению легочной гипертензии, в результате чего возникает гипоксия, усиливающая легочную гипертензию, в результате чего снижается синтез сурфактанта, т.е. возникает порочный круг.
Дефицит и незрелость сурфактанта имеются у плода в гестационном сроке менее 35 недель. Хроническая внутриутробная гипоксия усиливает и удлиняет этот процесс. Недоношенные дети (особенно глубоко недоношенные) составляют первый вариант течения РДСН. Даже пройдя без отклонений процесс родов, они могут развернуть клинику РДС в последующем, потому, что их пневмоциты II типа синтезируют незрелый сурфактант и очень чувчтвительны к любой гипоксии.
Другим, гораздо чаще встречающимся вариантом РДС, характерным для новорожденных, является сниженная возможность пневмоцитов "лавинообразно" синтезировать сурфактант сразу после рождения. Этиотропными здесь являются факторы, нарушающие физиологическое течение родов. При нормальных родах через естественные родовые пути возникает дозированная стимуляция симпато-адреналовой системы. Расправление легких при эффективном первом вдохе способствует снижению давления в малом круге кровообращения, улучшению перфузии пневмоцитов и усилению их синтетических функций. Любое отклонение от нормального течения родов, даже плановое оперативное родоразрешение, может вызвать процесс недостаточного синтеза сурфактанта с последующим развитием РДС.
Наиболее частой причиной развития этого варианта РДС является острая асфиксия новорожденных. РДС сопутствует этой патологии, вероятно, во всех случаях. РДС также возникает при аспирационных синдромах, тяжелой родовой травме, диафрагмальной грыже, часто при родоразрешении путем кесарева сечения.
Третьим вариантом развития РДС, характерного для новорожденных, является сочетание предшествующих видов РДС, которое встречается довольно часто у недоношенных.
Об остром респираторном дистресс-синдроме (АRDS) можно думать в тех случаях, когда ребенок перенес процесс родов без отклонений, а в последующем у него развернулась картина какого-либо заболевания, которое способствовало развитию гипоксии любого генеза, централизации кровообращения, эндотоксикоза.
Следует учитывать еще, что период острой адаптации у новорожденных, родившихся недоношенными или больными увеличивается. Считают, что период максимального риска проявлений нарушений дыхания у таких детей составляет: у родившихся от здоровых матерей - 24 часа, а от больных он длится, в среднем, до конца 2-х суток. При сохраняющейся высокой легочной гипертензии у новорожденных долго сохраняются фатальные шунты, которые способствуют развитию острой сердечной недостаточности и легочной гипертензии, которые являются важным компонентом в формировании РДС у новорожденных.
Таким образом, при первом варианте развития РДСН пусковым моментом является дефицит и незрелость сурфактанта, при втором - сохраняющаяся высокая легочная гипертензия и обусловленный ею нереализованный процесс синтеза сурфактанта. При третьем варианте ("смешанном") эти два момента сочетаются. Вариант формирования ARDS обусловлен развитием "шокового" легкого.
Все эти варианты РДС отягощаются в раннем неонатальном периоде ограниченными возможностями гемодинамики новорожденного.
Это способствует существованию такого термина как "кардиореспираторный дистресс-синдром" (КРДС).
Для более эффективной и рациональной терапии критических состояний у новорожденных следует разграничивать варианты формирования РДС.
В настоящее время основным методом интенсивной терапии РДСН является респираторная поддержка. Чаще всего ИВЛ при этой патологии приходится начинать с "жестких" параметров, при которых, помимо опасности баротравмы, еще существенно угнетается и гемодинамика. Чтобы избежать "жестких" параметров ИВЛ с высоким средним давлением в дыхательных путях средует ИВЛ начинать превентивно, не дожидаясь развития интерстициального отека легких и тяжелой гипоксии, т. е. тех состояний, когда развивается ARDS.
В случае предполагаемого развития РДС сразу после рождения следует или "смоделировать" эффективный "первый вдох", или пролонгировать эффективное дыхание (у недоношенных детей) с проведением заместительной терапии сурфактантом. В этих случаях ИВЛ не будет столь "жесткой" и длительной. У ряда детей появится возможность после кратковременной ИВЛ проводить СДППДВ через биназальные канюли до того времени, пока не пневмоциты не смогут "нарабатывать" достатчное количество зрелого сурфактанта.
Превентивное начало ИВЛ с ликвидацией гипоксии без использования "жесткой" ИВЛ позволит более эффективно использовать препараты, снижающие давление в малом круге кровообращения.
При таком варианте начала ИВЛ создаются условия для более раннего закрытия фетальных шунтов, что будет способствовать улучшению центральной и внутрилегочной гемодинамики.
II. ДИАГНОСТИКА.
А. Клинические признаки
- Симптомы дыхательной недостаточности, тахипноэ, вздутие грудной клетки, раздувание крыльев носа, затруднения при выдохе и цианоз.
- Другие симптомы, например, гипотензия, олигурия, мышечная гипотония, нестабильность температуры, парез кишечника, периферические отеки.
- Недоношенность при оценке гестационного возраста.
В течение первых часов жизни ребенку каждый час проводится клиническая оценка по модифицировванной шкале Downes, на основании которой делается вывод о наличии и динамике течения РДС и необходимом объеме респираторной помощи.
Оценка тяжести РДС (модифицированная шкала Downes)
|
Баллы Частота Цианоз дыхания в 1 мин. |
Втяжение |
Экспираторное хрюканье |
Характер дыхания при аускультации |
| 0 < 60 нет при 21% | нет | нет | пуэрильное |
| 1 60-80 есть, исчезает при 40% О2 | умеренное | выслушивает-
стетоскопом |
изменено
ослаблено |
| 2 > 80 исчезает или апноэ при | значитель | слышно
расстоянии |
плохо
проводится |
Оценка 2-3 балла соответствует РДС легкой степени
Оценка 4-6 баллов соответствует РДС средней степени
Оценка более 6 баллов соответствует тяжелому РДС
Б. РЕНТГЕНОГРАММА ГРУДНОЙ КЛЕТКИ. Характерные узловые или круглые затемнения и воздушная бронхограмма свидетельствуют о диффузных ателектазах.
В. ЛАБОРАТОРНЫЕ ПРИЗНАКИ.
- Соотношение Лецитин/Сфирингомиелин в амниотической жидкости менее 2.0 и отрицательные результаты пробы со встряхиванием при исследовании амниотической жидкости и желудочного аспирата. У новорожденных от матерей с сахарным диабетом РДС может развитиься при Л/С более 2,0.
- Отсутствие фосфатилдиглицерола в амниотической жидкости.
Кроме того, следует при появлении первых признаков РДС исследовать Hb/Ht, содержание глюкозы и лейкоцитов, при возможности КОС и газы крови.
III. ТЕЧЕНИЕ ЗАБОЛЕВАНИЯ.
А. ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ, нарастающая в течение 24-48 часов, а затем стабилизирующаяся.
Б. РАЗРЕШЕНИЮ часто предшествует увеличение темпа диуреза между 60 и 90 часом жизни.
IV. ПРОФИЛАКТИКА
При преждевременных родах в сроке 28-34 недели следует предпринять попытку тормодения родовой деятольности путем применения бета-миметиков, спазмолитиков либо сернокислой магнезии, после чего провести терапию глюкокортикоидами по одной из следующих схем:
- - бетаметазон по 12 мг в/м - через 12 часов - дважды;
- - дексаметазон по 5 мг в/м - каждые 12 часов - 4 введения;
- - гидрокортизон по 500 мг в/м - каждые 6 часов - 4 введения. Эффект наступает через 24 часа и длится в течение 7 дней.
При пролонгированной беременнности следует еженедельно вводить бета- или дексаметазон по 12 мг в/мышечно. Противопоказанием для применения глюкокортикоидов является наличие у беременной вирусной или бактериальной инфекции, а также язвенной болезни.
При мспользовании глюкокортикоидов следует проводить мониторинг сахара крови.
При предполагаемом родоразрешении путем кесарава сечения, при наличии условий, родоразрашение следует начинать с амниотомии, проводимой за 5-6 часов до операции с целью стимуляции симпатико-адреналовой системы плода, которая стимулирует его сурфактантную систему. При критическом состоянии матери и плода амниотомия на проводится!
Профилактике способствует бережное извлечение головки плода при кесаревом сечении, а у глубоко недоношенных детей извлечение головки плода в плодном пузыре.
V. ЛЕЧЕНИЕ.
Цель терапии РДС - поддержать новорожденного, пока не наступит разрешение заболевания. Потребление кислорода и продукцию углекислоты можно уменьшить, поддерживая оптимальный температурный режим. Поскольку функция почек в этот перид может быть нарушена, а перспирационные потери увеличиваются, очень важно тщательно поддерживать водно-электролитный баланс.
А. Поддержание проходимости дыхательных путей
- Положите новорожденного, слегка разогнув голову. Поворачивайте ребенка. Это улучшает дренаж трахеобронхиального дерева.
- Отсасывание из трахеи требуется для санации трахеобронхиального дерева от густой мокроты, появляющейся в экссудативную фазу, которая начинается приблизительно с 48-ми часов жизни.
Б. Кислородотерапия.
- Согретая, увлажненная и обогащенная кислородом смесь подается новорожденному в палатку или через эндотрахеальную трубку.
- Следует поддерживать оксигенацию между 50 и 80 мм.рт.ст., а сатурацию в промежутке 85%-95%.
В. Сосудистый доступ
1. Венозный пупочный катетер, конец которого находится выше диафрагмы, может быть полезен для обеспечения венозного доступа и измерения центрального венозного давления.
Г. Коррекция гиповолемии и анемии
- Контролируйте центральный гематокрит и артериальное давление, начиная с момента рождения ребенка.
- В течение острой фазы поддерживайте гематокрит в пределах 45-50% с помощью трансфузий. В фазе разрешения достаточно поддерживать гематокрит больше 35%.
Д. Ацидоз
- Метаболический ацидоз (ВЕ<-6 мЭкв/л) требует выявления возможной причины.
- Дефицит оснований менее -8 мЭкв/л обычно требует коррекции для поддержания рН более 7.25.
- Если рН падает ниже 7.25 за счет дыхательного ацидоза,то показана искусственная или вспомогательная вентиляция легких.
Е. Вскармливание
- Если гемодинамика новорожденного стабильна и вам удается купировать дыхательную недостаточность, то кормление следует начать на 48-72 час жизни.
- Избегайте кормления из соски, если одышка превышает 70 дыханий в минуту, т.к. высок риск аспирации.
- Если нет возможности начать энтеральное кормление, подумайте о парентеральном питании.
- Витамин А парентерально по 2000 Ед через день, пока не начато энтеральное кормление, снижает частоту хронических забований легких.
Ж. Рентгенологическое исследование грудной клетки
- Для постановки диагноза и оценки течения заболевания.
- Для подтверждения места стояния эндотрахеальной трубки, плеврального дренажа и пупочного катетера.
- Для диагностики таких осложнений, как пневмоторакс, пневмоперикардиум и некротический энтероколлит.
З. Возбуждение
- Отклонения РаО2 и РаСО2 могут вызывать и вызываться возбуждением. С такими детьми следует обращаться очень аккуратно и прикасаться к ним только по показаниям.
- Если новорожденный не синхронен с респиратором, для синхронизации с аппаратом и профилактики осложнений может потребоваться седация или миорелаксация.
И. Инфекция
- У большинства новорожденных с дыхательной недостаточностью следует исключать сепсис и пневмонию, поэтому целесообразно следует назначать эмпирическую антибактериальную терапию бактерицидными антибиотиками широкого спектра действия до молучения результатов посевов.
- Инфекция, вызванная гемолитическим стрептококком группы В может клинически и рентгенологически напоминать РДС.
К. Терапия острой дыхательной недостаточности
- Решение о применении методик дыхательной поддержки должно обосновываться в истории болезни.
- У новорожденных с массой тела менее 1500 г применение методик СРАР может привести к неоправданным затратам энергии.
- Надо изначально пытаться настроить параметры вентиляции та, чтобы снизить FiO2 до 0.6-0.8. Обычно для этого требуется поддерживать среднее давление в пределах 12-14 см Н2О.
- а. Когда РаО2 превысит 100 мм рт.ст., или не будет признаков гипоксиин, следует постепенно снижать FiO2 не более чем на 5% до 60%-65%.
- б. Эффект от снижения параметров вентиляции оценивается через 15-20 минут по анализу газов крови или пульсоксиметру.
- в. При низких концентрациях кислорода (менее 40%) оказывася достаточным снижение FiO2 на 2%-3%.
5. В острую фазу РДС может наблюдаться задержка углекислого газа.
- а. Поддерживайте рСО2 меньше 60 мм рт.ст., изменяя частоту вентиляции или пиковое давление.
- б. Если ваши попытки купировать гиперкапнию приводят к нарушению оксигенации, проконсультируйтесь с более опытыми коллегами.
Л. Причины ухудшения состояния больного
- Разрыв альвеол и развитие интерстициальной эмфиземы легких, пневмоторакса или пневмоперикардиума.
- Нарушение герметичности дыхательного контура.
- а. Проверьте места подсоединения аппаратуры к источнику кислорода и сжатого воздуха.
- б. Исключите обструкцию эндотрахеальной трубки, экстубацию или продвижение трубки в правый главный бронх.
- в. Если выявлена обструкция эндотрахеальной трубки или самоэкстубация, уберите старую эндотрахеальную трубку и раздышите ребенка мешком и маской. Переинтубацию лучше производить после стабилизации состояния больного.
3. При очень тяжелом РДС может происходить шунтирование крови справа налево через артериальный проток.
4. Когда функция внешнего дыхания улучшается, сопротовление сосудов малого круга может резко снижаться, обусловливая шунтирование через артериальный проток слева направо.
5. Гораздо реже ухудшение состояния новорожденных обусловлено внутричерепным кровоизлиянием, септическим шоком, гипогликемией, ядерной желтухой, транзиторной гипераммониемией или врожденными дефектами метаболизма.
Шкала подбора некоторых параметров ИВЛ у новорожденных с РДС
| Масса тела, г | < 1500 | > 1500 | ||
|
PEEP, см.H2O |
PIP, см.H2O |
PIP, см.H2O |
||
Примечание: Данная схема является лищь ориентиром. Параметры ИВЛ могут быть изменены, исходя из клиники заболевания, газов крови и КОС и данных пульсовой оксиметрии.
Критерии применения мероприятий респираторной терапии
|
FiO2, требующееся для поддержания рО2 > 50 мм рт.ст. |
||
| <24 часов | 0,65 | Неинвазивные методы (О2-терапия,
СДППДВ)
Интубация трахеи (ИВЛ, ВИВЛ) |
| >24 часов | 0,80 | Неинвазивные методы
Интубация трахеи |
М. Терапия сурфактантом
- а. В настоящий момент проходят испытания человеческий, синтетический и сурфактант животных. В России для клинического применения разрешен сурфактант "ЭКЗОСУРФ НЕОНАТАЛ, фирмы Glaxo Wellcome.
- б. Назначается профилактически в родовом зале или позже, в сроки от 2-х до 24 часов. Профилактическое применение сурфактанта показано: недоношенным новорожденным с массой тела при рождении менее 1350 г с высоким риском развития РДС; новорожденным с массой тела более 1350 г с подтвержденной объективными методами незрелостью легких. С лечебной целью сурфактант применяется новорожденным с клинически и рентгенологически подтвержденным диагнозом РДС, находящимся на ИВЛ через эндотрахеальную трубку.
- в. Вводится в дыхательные пути в виде суспензии на фиэрастворе. С профилактической целью "Экзосурф" вводится от 1 до 3 раз, с лечебной - 2 раза. Однократная доза "Экзосурфа" во всех случаях составляет 5 мл/кг. и вводится болюсно двумя полудозами за период времени от 5 до 30 минут в завмсимости от реакции ребенка. Безопаснее вводить раствор микроструйно со скоростью 15-16 мл/ч. Повторная доза "Экзосурфа" вводится через 12 часов после введения первоначальной.
- г. Уменьшает тяжесть РДС, но потребность в ИВЛ сохраняется и частота хронических заболеваний легких не уменьшается.
VI. ТАКТИЧЕСКИЕ МЕРОПРИЯТИЯ
Возглавляет бригаду специалистов по лечению РДС неонатолог. поготовленный по реанимации и интенсивной терапии или квалифицированный реаниматолог.
Из ЛУ с УРНП 1 - 3 обязательно обращение в РКЦН и очная консультация в 1-е сутки. Перегоспитализация в специализированный центр по реанимации и интенсивной терапии новорожденных после стабилизации состояния больного через 24-48 часов силами РКБН.
Патологическое состояние новорожденных, возникающее в первые часы и сутки после рождения вследствие морфофункциональной незрелости легочной ткани и дефицита сурфактанта. Синдром дыхательных расстройств характеризуется дыхательной недостаточностью различной степени выраженности (тахипноэ, цианозом, втяжением уступчивых мест грудной клетки, участием вспомогательной мускулатуры в акте дыхания), признаками угнетения ЦНС и нарушения кровообращения. Синдром дыхательных расстройств диагностируется на основании клинических и рентгенологических данных, оценке показателей зрелости сурфактанта. Лечение синдрома дыхательных расстройств включает оксигенотерапию, инфузионную терапию, антибиотикотерапию, эндотрахеальную инстилляцию сурфактанта.

Общие сведения
Синдром дыхательных расстройств (СДР) – патология раннего неонатального периода, обусловленная структурно-функциональной незрелостью легких и связанным с ней нарушением образования сурфактанта. В зарубежной неонатологии и педиатрии термин «синдром дыхательных расстройств» тождественен понятиям «респираторный дистресс-синдром », «болезнь гиалиновых мембран», «пневмопатии». Синдром дыхательных расстройств развивается примерно у 20% недоношенных (у детей, рожденных ранее 27 недель гестации, – в 82-88% случаев) и 1-2% доношенных новорожденных. Среди причин перинатальной смертности на долю синдрома дыхательных расстройств приходится, по различным данным, от 35 до 75%, что указывает на актуальность и во многом еще нерешенность проблемы выхаживания детей с СДР.

Причины синдрома дыхательных расстройств
Как уже указывалось, патогенез синдрома дыхательных расстройств у новорожденных связан с незрелостью легочной ткани и обусловленной этим недостаточностью антиателектатического фактора - сурфактанта, его неполноценностью, ингибированием или повышенным разрушением.
Сурфактант представляет собой поверхностно-активный липопротеиновый слой, покрывающий альвеолярные клетки и уменьшающий поверхностное натяжение легких, т. е. предупреждающий спадение стенок альвеол. Сурфактант начинает синтезироваться альвеолоцитами с 25-26 недели внутриутробного развития плода, однако его наиболее активное образование происходит с 32-34 недели гестации. Под действием многих факторов, в числе которых гормональная регуляция глюкокортикоидами (кортизолом), катехоламинами (адреналином и норадреналином), эстрогенами, гормонами щитовидной железы, созревание системы сурфактанта завершается к 35-36-й неделе гестации.
Поэтому, чем ниже гестационный возраст новорожденного, тем меньше у него количество сурфактанта в легких. В свою очередь, это приводит к спадению стенок альвеол на выдохе, ателектазу, резкому снижению площади газообмена в легких, развитию гипоксемии, гиперкапнии и респираторного ацидоза. Нарушение альвеолокапиллярной проницаемости приводит к пропотеванию плазмы из капилляров и последующему выпадению гиалиноподобных веществ на поверхность бронхиол и альвеол, что еще в большей степени снижает синтез сурфактанта и способствует развитию ателектазов легких (болезнь гиалиновых мембран). Ацидоз и легочная гипертензия поддерживают сохранение фетальных коммуникаций (открытого овального окна и артериального протока) – это также усугубляет гипоксию, приводит к развитию ДВС-синдрома, отечно-геморрагического синдрома, дальнейшему нарушению образованию сурфактанта.
Риск развития синдрома дыхательных расстройств повышается при недоношенности, морфо-функциональной незрелости по отношению к гестационному возрасту, внутриутробных инфекциях , гипоксии плода и асфиксии новорожденного , ВПС , пороках развития легких , внутричерепных родовых травмах , многоплодии, аспирации мекония и околоплодных вод, врожденном гипотиреозе и др. Материнскими факторами риска развития синдрома дыхательных расстройств у новорожденного могут служить сахарный диабет , анемия, родовое кровотечение , родоразрешение с помощью кесарева сечения.
Классификация синдрома дыхательных расстройств
На основании этиологического принципа различают синдром дыхательных расстройств гипоксического, инфекционного, инфекционно-гипоксического, эндотоксического, генетического (при генетически обусловленной патологии сурфактанта) генеза.
На основании развивающихся патологических сдвигов выделяют 3 степени тяжести синдрома дыхательных расстройств.
I (легкая степень) – возникает у относительно зрелых детей, имеющих при рождении состояние средней тяжести. Симптоматика развивается только при функциональных нагрузках: кормлении, пеленании, проведении манипуляций. ЧД менее 72 в мин.; газовый состав крови не изменен. Состояние новорожденного нормализуется в течение 3-4 дней.
II (средне-тяжелая степень) – ребенок рождается в тяжелом состоянии, которое нередко требует проведения реанимационных мероприятий. Признаки синдрома дыхательных расстройств развиваются в течение 1-2 часов после рождения и сохраняются до 10 суток. Необходимость в дотации кислорода обычно отпадает на 7-8 сутки жизни. На фоне синдрома дыхательных расстройств у каждого второго ребенка возникает пневмония .
III (тяжелая степень) – обычно возникает у незрелых и глубоко недоношенных детей. Признаки синдрома дыхательных расстройств (гипоксия, апноэ, арефлексия, цианоз, резкое угнетение ЦНС, нарушение терморегуляции) возникают с момента рождения. Со стороны сердечно-сосудистой системы отмечается тахикардия или брадикардия , артериальная гипотония , признаки гипоксии миокарда на ЭКГ . Велика вероятность летального исхода.
Симптомы синдрома дыхательных расстройств
Клинические проявления синдрома дыхательных расстройств обычно развиваются на 1-2 сутки жизни новорожденного. Появляется и интенсивно нарастает одышка (ЧД до 60–80 в минуту) с участием в дыхательном акте вспомогательной мускулатуры, втяжением мечевидного отростка грудины и межреберий, раздуванием крыльев носа. Характерны экспираторные шумы («хрюкающий выдох»), обусловленные спазмом голосовой щели, приступы апноэ, синюшность кожных покровов (сначала периоральный и акроцианоз, затем – общий цианоз), пенистые выделения изо рта часто с примесью крови.
У новорожденных с синдромом дыхательных расстройств отмечаются признаки угнетения ЦНС, обусловленные гипоксией, нарастание отека мозга , склонность к внутрижелудочковым кровоизлияниям. ДВС-синдром может проявляться кровоточивостью из мест инъекций, легочным кровотечением и т. д. При тяжелой форме синдрома дыхательных расстройств стремительно развивается острая сердечная недостаточность с гепатомегалией , периферическими отеками.
Другими осложнениями синдрома дыхательных расстройств могут являться пневмонии, пневмоторакс , эмфизема легких , отек легких , ретинопатия недоношенных , некротический энтероколит , почечная недостаточность , сепсис и др. В исходе синдрома дыхательных расстройств у ребенка может отмечаться выздоровление, гиперреактивность бронхов, перинатальная энцефалопатия , нарушения иммунитета, ХНЗЛ (буллезная болезнь, пневмосклероз и др.).
Диагностика синдрома дыхательных расстройств
В клинической практике для оценки степени тяжести синдрома дыхательных расстройств используется шкала И. Сильвермана, где в баллах (от 0 до 2-х) оцениваются следующие критерии: экскурсия грудной клетки, втяжение межреберий на вдохе, западение грудины, раздувание ноздрей, опускание подбородка на вдохе, экспираторные шумы. Суммарная оценка ниже 5 баллов свидетельствует о легкой степени синдрома дыхательных расстройств; выше 5 – средней, 6-9 баллов - о тяжелой и от 10 баллов – о крайне тяжелой степени СДР.
В диагностике синдрома дыхательных расстройств решающее значение отводится рентгенографии легких . Рентгенологическая картина изменяется в различные патогенетические фазы. При рассеянных ателектазах выявляется мозаичная картина, обусловленная чередованием участков снижения пневматизации и вздутия легочной ткани. Для болезни гиалиновых мембран характерны «воздушная бронхограмма», ретикулярно-надозная сетка. В стадии отечно-геморрагического синдрома определяется нечеткость, размытость легочного рисунка, массивные ателектазы, определяющие картину «белого легкого».
Для оценки степени зрелости легочной ткани и системы сурфактанта при синдроме дыхательных расстройств применяется тест, определяющий отношение лецитина к сфингомиелину в околоплодных водах, трахеальном или желудочном аспирате; «пенный» тест с добавлением этанола в анализируемую биологическую жидкость и др. Возможно использование этих же тестов при проведении инвазивной пренатальной диагностики - амниоцентеза , осуществляемого после 32 недели гестации., детского пульмонолога , детского кардиолога и др.
Ребенок с синдромом дыхательных расстройств нуждается в непрерывном контроле ЧС, ЧД, газового состав крови, КОС; мониторинге показателей общего и биохимического анализа крови, коагулограммы, ЭКГ. Для поддержания оптимальной температуры тела ребенок помещается в кувез, где ему обеспечивается максимальный покой, ИВЛ или ингаляции увлажненного кислорода через носовой катетер, парентеральное питание. Ребенку периодически выполняется трахеальная аспирация, вибрационный и перкуторный массаж грудной клетки .
При синдроме дыхательных расстройств проводится инфузионная терапия раствором глюкозы, гидрокарбоната натрия; трансфузии альбумина и свежезамороженной плазмы; антибиотикотерапия, витаминотерапия, диуретическая терапия. Важным слагаемым профилактики и лечения синдрома дыхательных расстройств является эндотрахеальная инстилляция препаратов сурфактанта.
Прогноз и профилактика синдрома дыхательных расстройств
Последствия синдрома дыхательных расстройств определяются сроком родов, тяжестью дыхательной недостаточности , присоединившимися осложнениями, адекватностью проведения реанимационных и лечебных мероприятий.
В плане профилактики синдрома дыхательных расстройств наиболее важным представляется предупреждение преждевременных родов . В случае угрозы преждевременных родов необходимо проведение терапии, направленной на стимуляцию созревание легочной ткани у плода (дексаметазон, бетаметазон, тироксин, эуфиллин). Недоношенным детям необходимо проводить раннюю (в первые часы после рождения) заместительную терапию сурфактантом.
В дальнейшем дети, перенесшие синдром дыхательных расстройств, кроме участкового педиатра , должны наблюдаться детским неврологом, детским пульмонологом,
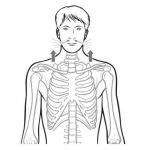
Втяжение нижней стенки грудной клетки (движение вовнутрь костной структуры стенки грудной клетки на вдохе) является показателем тяжелой пневмонии. Этот симптом более специфичен, чем втяжение межреберных промежутков, которое затрагивает втяжение мягких тканей межреберий, но не костной структуры стенки грудной клетки.
· Если при подсчете частоты дыхания ребенка вы не подняли его рубашку, попросите мать сделать это сейчас.
· Перед тем, как вы посмотрите, есть ли втяжение грудной клетки, понаблюдайте за ребенком, чтобы определить, когда он вдыхает, а когда - выдыхает.
· Посмотрите, есть ли втяжение грудной клетки на вдохе .
· Посмотрите на нижнюю часть грудной клетки (нижние ребра). У ребенка есть втяжение грудной клетки, если при вдохе нижняя часть грудной клетки западает .
Втяжение грудной клетки происходит тогда, когда ребенок прилагает для вдоха гораздо больше усилий, чем необходимо при нормальном дыхании. При нормальном дыхании на вдохе поднимаются вся грудная клетка (верхняя и нижняя части) и живот . При наличии втяжений грудной клетки стенка грудной клетки западает, когда ребенок вдыхает .
Примечание: Для того, чтобы сделать вывод о наличии втяжения грудной клетки, оно должно быть четко видно и присутствовать все время. Если втяжение грудной клетки заметно только тогда, когда ребенок кричит или кормится, это значит, что у ребенка нет втяжения грудной клетки. Если западают только мягкие ткани межреберий (втяжение межреберных промежутков или западение межреберных промежутков), значит, у ребенка нет втяжения грудной клетки. Для данной оценки втяжение грудной клетки означает втяжение нижней части стенки грудной клетки. Втяжение межреберных промежутков сюда не относится .
Респираторный дистресс синдром новорожденного, болезнь гиалиновых мембран - тяжелое расстройство дыхания у недоношенных новорожденных, обусловленное незрелостью легких и первичным дефицитом сурфактанта.
Эпидемиология
Респираторный дистресс синдром является наиболее частой причиной возникновения дыхательной недостаточности в раннем неонатальном периоде у недоношенных новорожденных. Встречаемость его тем выше, чем меньше гестационный возраст и масса тела ребенка при рождении. Проведение пренатальной профилактики при угрозе преждевременных родов также влияет на частоту развития респираторного дистресс синдрома.
У детей, родившихся ранее 30 нед гестации и не получавших пренатальной профилактики стероидными гормонами, его частота составляет около 65%, при наличии пренатальной профилактики - 35%; у детей, родившихся на сроке гестации 30-34 нед без профилактики - 25%, при проведении профилактики - 10%.
У недоношенных детей, родившихся на сроке более 34 недель гестации, его частота не зависит от пренатальной профилактики и составляет менее 5%.
Этиология и патогенез
Основными причинами развития респираторного дистресс синдрома у новорожденных являются:
- нарушение синтеза и экскреции сурфактанта альвеолоцитами 2-го типа, связанное с функциональной и структурной незрелостью легочной ткани;
- врожденный качественный дефект структуры сурфактанта, что является крайне редкой причиной.
При дефиците (или сниженной активности) сурфактанта повышается проницаемость альвеолярных и капиллярных мембран, развивается застой крови в капиллярах, диффузный интерстициальный отек и перерастяжение лимфатических сосудов; происходит спадение альвеол и формирование ателектазов. Вследствие этого уменьшаются функциональная остаточная емкость, дыхательный объем и жизненная емкость легких.
Как следствие, увеличивается работа дыхания, происходит внутрилегочное шунтирование крови, нарастает гиповентиляция легких. Этот процесс приводит к развитию гипоксемии, геперкапнии и ацидоза.На фоне прогрессирующей дыхательной недостаточности возникают нарушения функции сердечно-сосудистой системы: вторичная легочная гипертензия с право-левым шунтом крови через функционирующие фетальные коммуникации, транзиторная дисфункция миокарда правого и/или левого желудочков, системная гипотензия.
При патологоанатомическом исследовании - легкие безвоздушные, тонут в воде. При микроскопии отмечаются диффузные ателектазы и некроз клеток альвеолярного эпителия. Многие из расширенных терминальных бронхиол и альвеолярных ходов содержат эозинофильные мембраны на фибриновой основе. Следует отметить, что гиалиновые мембраны редко обнаруживают у новорожденных, умерших от респираторного дистресс синдрома в первые часы жизни.
Пренатальная профилактика
При угрозе преждевременных родов беременных следует транспортировать в акушерские стационары 2-3 го уровня, где имеются отделения реанимации новорожденных. При угрозе преждевременных родов на 32-й неделе гестации и менее транспортировка беременных должна осуществляться в стационар 3-го уровня (в перинатальный центр) (С).
Беременным женщинам на сроке гестации 23-34 нед при угрозе преждевременных родов следует назначать курс кортикостероидов для профилактики респираторного дистресс синдрома недоношенных и снижения риска возможных неблагоприятных осложнений таких, как внутрижелудочковые кровоизлияния и некротический энтероколит (А).
Могут быть использованы две альтернативные схемы пренатальной профилактики респираторного дистресс синдрома:
- бетаметазон - 12 мг внутримышечно через 24 ч, всего 2 дозы на курс;
- дексаметазон - 6 мг внутримышечно через 12 часов, всего 4 дозы на курс.
Максимальный эффект терапии стероидами развивается спустя 24 ч и продолжается неделю. К концу второй недели эффект от терапии стероидами значительно снижается. Второй курс профилактики респираторного дистресс синдрома кортикостероидами показан спустя 2-3 нед после первого в случае повторного возникновения угрозы преждевременных родов на сроке гестации менее 33 нед (А). Целесообразно так же назначение кортикостероидной терапии женщинам на сроке гестации 35-36 нед в случае запланированного кесарева сечения при отсутствии у женщины родовой деятельности. Назначение курса кортикостероидов женщинам этой категории не влияет на исходы у новорожденных, однако снижает у детей риск развития дыхательных нарушений и, как следствие, поступление в отделение реанимации новорожденных (В).
При угрозе преждевременных родов на ранних сроках целесообразно использовать коротким курсом токолитики для задержки наступления родов с целью транспортировки беременных в перинатальный центр, а так же для завершения полного курса антенатальной профилактики респираторного дистресс синдрома кортикостероидами и наступления полного терапевтического эффекта (В). Преждевременное излитие околоплодных вод не является противопоказанием к торможению родовой деятельности и профилактическому назначению кортикостероидов.
Антибактериальная терапия показана женщинам при преждевременном разрыве плодных оболочек (преждевременном излитии околоплодных вод), поскольку снижает риск наступления преждевременных родов (А). Однако следует избегать назначения амоксициллина + клавулановой кислоты в связи с повышенным риском развития у недоношенных некротического энтероколита. Следует так же избегать широкого назначения цефалоспоринов III поколения в связи с выраженным их влиянием на формирование полирезистентных госпитальных штаммов в стационаре (С).
Диагностика респираторного дистресс-синдрома
Факторы риска
Предрасполагающими факторами развития респираторного дистресс синдрома, которые могут быть выявлены до рождения ребенка или в первые минуты жизни, являются:
- развитие дыхательных расстройств у сибсов;
- сахарный диабет у матери;
- тяжелая форма гемолитической болезни плода;
- преждевременная отслойка плаценты;
- преждевременные роды;
- мужской пол плода при преждевременных родах;
- кесарево сечение до начала родовой деятельности;
- асфиксия плода и новорожденного.
Клиническая картина:
Одышка, возникающая в первые минуты - первые часы жизни
Экспираторные шумы («стонущее дыхание»), обусловленные развитием компенсаторного спазма голосовой щели на выдохе.
Западение грудной клетки на вдохе (втягивание мечевидного отростка грудины, подложечной области, межреберий, надключичных ямок) с одновременным возникновением напряжения крыльев носа, раздувания щек (дыхание «трубача»).
Цианоз при дыхании воздухом.
Ослабление дыхания в легких, крепитирующие хрипы при аускультации.
Нарастающая потребность в дополнительной оксигенации после рождения.
Клиническая оценка тяжести дыхательных расстройств
Клиническая оценка степени тяжести дыхательных нарушений проводится по шкале Сильвермана (Silverman) у недоношенных и по шкале Доунс (Downes) у доношенных новорожденных не столько с диагностической целью, сколько для оценки эффективности проводимой респираторной терапии или в качестве показания для ее начала. Наряду с оценкой потребности новорожденного в дополнительной оксигенации может быть критерием для изменения тактики лечения.
Рентгенологическая картина
Рентгенологическая картина респираторного дистресс-синдрома новорожденных зависит от тяжести заболевания - от небольшого уменьшения пневматизации до «белых легких». Характерными признаками являются: диффузное снижение прозрачности легочных полей, ретикулогранулярный рисунок и полоски просветлений в области корня легкого (воздушная бронхограмма). Однако данные изменения неспецифичны и могут выявляться при врожденном сепсисе, врожденной пневмонии. Рентгенологическое исследование в первые сутки жизни показано всем новорожденным с дыхательными нарушениями.
Лабораторные исследования
Всем новорожденным с дыхательными нарушениями в первые часы жизни наряду с рутинными анализами крови на кислотно-основное состояние, газовый состав и уровень глюкозы, рекомендуется также проводить анализы маркеров инфекционного процесса с целью исключения инфекционного генеза дыхательных нарушений.
Проведение клинического анализа крови с подсчетом нейтрофильного индекса.
Определение уровня С-реактивного белка в крови.
Микробиологический посев крови (результат оценивается не ранее, чем через 48 ч).
При проведении дифференциального диагноза с тяжелым течением врожденного сепсиса у пациентов, нуждающихся в жестких режимах инвазивной искусственной вентиляции легких, при непродолжительном эффекте от повторных введений экзогенного сурфактанта рекомендуется определение уровня про-кальцитонина в крови.
Определение уровня С-реактивного белка и проведение клинического анализа крови целесообразно повторить спустя 48 ч, если в первые сутки жизни ребенка диагноз респираторного дистресс-синдрома выставить затруднительно. Респираторный дистресс-синдром характеризуется отрицательными маркерами воспаления и отрицательным результатом микробиологического посева крови.
Дифференциальная диагностика
Дифференциальный диагноз проводится со следующими заболеваниями. Транзиторное тахипноэ новорожденных. Заболевание может встречаться при любом гестационном возрасте новорожденных, но более характерно для доношенных, особенно после кесарева сечения. Заболевание характеризуется отрицательными маркерами воспаления и быстрым регрессом дыхательных нарушений. Нередко требуется проведение назального режима искусственной вентиляции лёгких постоянным положительным давлением. Характерно быстрое снижение потребности в дополнительной оксигенации на фоне проведения режим искусственной вентиляции лёгких постоянным положительным давлением. Крайне редко требуется проведение инвазивной искусственной вентиляции легких. Отсутствуют показания для введения экзогенного сурфактанта. В отличие от респираторного дистресс-синдрома при транзиторном тахипноэ на рентгенограмме органов грудной клетки характерно усиление бронхососудистого рисунка, признаки жидкости в междолевых щелях, и/или плевральных синусах.
Врожденный сепсис, врожденная пневмония. Начало заболевания может протекать клинически идентично респираторному дистресс-синдрому. Характерны положительные маркеры воспаления, определяемые в динамике в первые 72 ч жизни. Рентгенологически при однородном процессе в легких врожденный сепсис/пневмония неотличимы от респираторного дистресс-синдрома. Однако, очаговые (инфильтративные тени) свидетельствуют об инфекционном процессе и не характерны для респираторного дистресс-синдрома
Синдром мекониальной аспирации. Заболевание характерно для доношенных и переношенных новорожденных. Наличие мекониальных околоплодных вод и дыхательных нарушений с рождения, их прогрессирование, отсутствие лабораторных признаков инфекции, а также характерные изменения на рентгенограмме органов грудной клетки (инфильтративные тени перемежаются эмфизематозными изменениями, ателектазами, возможны пневмомедиастинум и пневмоторакс) говорят в пользу диагноза «синдром мекониальной аспирации»
Синдром утечки воздуха, пневмоторакс. Диагноз ставится на основании характерной рентгенологической картины в легких.
Персистирующая легочная гипертензия. На рентгеновском снимке органов грудной клетки отсутствуют характерные для респираторного дистресс-синдрома изменения. При эхокардио-графическом исследовании выявляется право-левый сброс и признаки легочной гипертензии.
Аплазия/гипоплазия легких. Диагноз, как правило, ставится пренатально. Постнатально диагноз выставляется на основании характерной рентгенологической картины в легких. Для уточнения диагноза возможно проведение компьютерной томографии легких.
Врожденная диафрагмальная грыжа. Рентгенологические признаки транслокации органов брюшной полости в грудную свидетельствует в пользу диагноза «врожденная диафрагмальная грыжа». Особенности оказания первичной и реанимационной помощи новорожденным из группы высокого риска по развитию респираторного дистресс-синдрома в родильном залеДля повышения эффективности профилактики и лечения респираторного дистресс-синдрома в родильном зале применяется комплекс технологий
Профилактика гипотермии в родильном зале у недоношенных новорожденных
Профилактика гипотермии является одним из ключевых элементов выхаживания критически больных и глубоконедоношенных детей. При ожидающихся преждевременных родах температура в родильном зале должна составлять 26-28 °С. Основные мероприятия по обеспечению тепловой защиты проводятся в первые 30 с жизни в рамках начальных мероприятии первичной помощи новорожденному. Объем мероприятии профилактики гипотермии различается у недоношенных детей c массой тела более 1000 г (срок гестации 28 нед и более) и у детей с массой тела менее 1000 г (срок гестации менее 28 нед).
У недоношенных детей, родившихся на сроке гестации 28 недель и более, также как и у доношенных новорожденных, используется стандартный объем профилактических мероприятии: обсушивание кожных покровов и обертывание в теплые сухие пеленки. Поверхность головы ребенка дополнительно защищается от теплопотери при помощи пеленки или шапочки. Для контроля эффективности проводимых мероприятии и профилактики гипертермии всем недоношенным детям рекомендуется проводить непрерывный мониторинг температуры тела в родильном зале, а также фиксировать температуру тела ребенка при поступлении в блок интенсивной терапии. Профилактика гипотермии у недоношенных детей, родившихся до завершения 28-и недели гестации, предусматривает обязательное использование пластиковой пленки (пакета) (А).
Отсроченное пережатие и пересечение пуповины
Пережатие и пересечение пуповины спустя 60 секунд после рождения у недоношенных новорожденных приводит к значительному снижению частоты некротического энтероколита, внутрижелудочкового кровтотечения, снижению потребности в гемотрансфузиях (А).Методы респираторнойтерапии (стабилизация дыхания)
Неинвазивная респираторная терапия в родильном зале
В настоящее время для недоношенных детей предпочтительным считается стартовая терапия методом искусственной вентиляции лёгких постоянным положительным давлениемс предшествующим продленным раздуванием легких. Создание и поддержание постоянного положительного давления в дыхательных путях является необходимым элементом ранней стабилизации состояния глубоконедоношенного ребенка, как при спонтанном дыхании, так и на искусственной вентиляции легких. Постоянное положительное давление в дыхательных путях способствует созданию и поддержанию функциональной остаточной емкости легких, препятствует ателектазированию, снижает работу дыхания. Исследования последних лет показали эффективность так называемого «продленного раздувания легких» в качестве старта респираторной терапии у недоношенных новорожденных. Маневр «продленного раздувания» легких представляет собой удлиненный искусственный вдох. Его следует проводить в первые 30 с жизни, при отсутствии самостоятельного дыхания или при дыхании типа «gasping» с давлением 20-25 см Н2О в течение 15-20 с (В). При этом у недоношенных детей эффективно формируется остаточная емкость легких. Этот прием выполняется однократно. Маневр можно выполнить с помощью ручного аппарата с Т-коннектором или автоматического аппарата искусственной вентиляции легких, обладающего возможностью удерживать необходимое давление на вдохе 15-20 с. Невозможно выполнить продленное раздувание легких с помощью дыхательного мешка. Обязательным условием выполнения данного маневра является регистрация показателей ЧСС и SpCh методом пульсоксиметрии, которая позволяет оценить эффективность его и прогнозировать дальнейшие действия.
Если ребенок с рождения кричит, активно дышит, то продленное раздувание проводить не следует. В этом случае детям, родившимся на сроке гестации 32 недели и менее, следует респираторную терапию начинать методом искусственной вентиляции лёгких постоянным положительным давлением с давлением 5-6 см Н2О. Недоношенным, родившимся на сроке гестации более 32 нед, режим искусственной вентиляции лёгких постоянным положительным давлениемследует проводить при наличии дыхательных нарушений (A).Указанная выше последовательность действий приводит к меньшей потребности в проведении инвазивной искусственной вентиляции легких у недоношенных, что в свою очередь ведет к меньшему использованию сурфактантной терапии и меньшей вероятности развития осложнений, связанных с искусственной вентиляцией легких (С).
При проведении неинвазивной респираторной терапии недоношенным в родильном зале необходимо введение в желудок зонда для декомпрессии на 3-5-й минуте. Критериями неэффективности режима искусственной вентиляции лёгких постоянным положительным давлением (помимо брадикардии) как стартового метода респираторной поддержки можно считать нарастание степени тяжести дыхательных нарушении в динамике в течение первых 10-15 мин жизни на фоне режима искусственной вентиляции лёгких постоянным положительным давлением: выраженное участие вспомогательной мускулатуры, потребность в дополнительной оксигенации (FiO2 >0,5). Эти клинические признаки свидетельствуют о тяжелом течении респираторного заболевания у недоношенного, что требует введения экзогенного сурфактанта.
Режим искусственной вентиляции лёгких постоянным положительным давлением в родильном зале может осуществляться аппаратом искусственной вентиляции легких при наличии функции искусственной вентиляции лёгких постоянным положительным давлением, ручным аппаратом искусственной вентиляции легких с Т-коннектором, различными системами искусственной вентиляции лёгких постоянным положительным давлением. Методика искусственной вентиляции лёгких постоянным положительным давлениемможет проводиться при помощи лицевой маски, назофарингеальной трубки, интубационной трубки (используемой в качестве назофа-рингеальной) биназальных канюль. На этапе родильного зала методика проведения искусственной вентиляции лёгких постоянным положительным давлением существенного значения не имеет.
Применение искусственной вентиляции лёгких постоянным положительным давлением в родильном зале противопоказано детям:
- с атрезией хоан или другими врожденными пороками развития челюстно-лицевой области, препятствующими правильному наложению назальных канюль, маски, назофарингеальной трубки;
- с диагностированным пневмотораксом;
- с врожденной диафрагмальной грыжей;
- с врожденными пороками развития, не совместимыми с жизнью (анэнцефалия и т. п.);
- с кровотечением (легочным, желудочным, кровоточивостью кожных покровов). Особенности проведения искусственной вентиляции легких в родильном зале у недоношенных
Искусственная вентиляция легких у недоношенных проводится при сохраняющейся на фоне режима искусственной вентиляции лёгких постоянным положительным давлением брадикардии и/или при длительном (более 5 мин) отсутствии самостоятельного дыхания.
Необходимыми условиями для эффективной искусственной вентиляции легких у глубоко недоношенных новорожденных являются:
- контроль давления в дыхательных путях;
- обязательное поддержание Реер +4-6 см Н2О;
- возможность плавной регулировки концентрации кислорода от 21 до 100%;
- непрерывный мониторинг частоты сердечных сокращений и SрO2.
Стартовые параметры искусственной вентиляции легких: PIP - 20-22 см Н2О, РEEP - 5 см Н2О, частота 40-60 вдохов в минуту. Основным показателем эффективности искусственной вентиляции легких является возрастание частоты сердечных сокращений >100 уд/мин. Такие общепринятые критерии, как визуальная оценка экскурсии грудной клетки, оценка цвета кожных покровов у глубоконедоношенных детей имеют ограниченную информативность, так как не позволяют оценить степень инвазивности респираторной терапии. Так, хорошо видимая на глаз экскурсия грудной клетки у новорожденных с экстремально низкой массой тела с большой долей вероятности указывает на вентиляцию избыточным дыхательным объемом и высокий риск волюм-травмы.
Проведение инвазивной искусственной вентиляции легких в родильном зале под контролем дыхательного объема у глубоко недоношенных пациентов является перспективной технологией, позволяющей минимизировать ИВЛ-ассоциированные повреждения легких. При верификации положения интубационнои трубки наряду с методом аускультации у детеи с экстремально низкои массои тела целесообразно использование метода капнографии или колориметрического метода индикации СО2 в выдыхаемом воздухе.
Оксигенотерапия и пульсоксиметрия у недоношенных новорожденных в родильном зале
«Золотым стандартом» мониторинга в родильном зале при оказании первич-нои и реанимационнои помощи недоношенным новорожденным является мониторинг показателем ЧСС и SрO2 методом пульсоксиметрии. Регистрация ЧСС и SaO2 методом пульсоксиметрии начинается с первои минуты жизни. Пульсоксиметрическии датчик устанавливается в области запястья или предплечья правои руки ребенка («предуктально») при проведении начальных мероприятии.
Пульсоксиметрия в родильном зале имеет 3 основные точки приложения:
- непрерывныи мониторинг частоты сердечных сокращений начиная с первых минут жизни;
- предупреждение гипероксии (SрO2 не более 95% на любом этапе проведения реанимационных мероприятии, если ребенок получает дополнительный кислород);
- предупреждение гипоксии SрO2 не менее 80% к 5 минуте жизни и не менее 85% к 10 минуте жизни).
Стартовую респираторную терапии у детей, родившихся на сроке гестации 28 нед и менее следует осуществлять с FiO2 0,3. Респираторная терапия у детей большего гестационного возраста осуществляется воздухом.
Начиная с конца 1-и минуты следует ориентироваться на показатели пульсок-симетра и следовать описанному ниже алгоритму изменения концентрации кислорода. При нахождении показателеи ребенка за пределами указанных значении, следует изменять (увеличивать/ уменьшать) концентрацию дополнительного О2 ступенчато на 10-20% каждую последующую минуту до достижения целевых показателеи. Исключение составляют дети, требующие непрямого массажа сердца на фоне проведения искусственной вентиляции легких. В этих случаях одновременно с началом непрямого массажасердца концентрацию О2 следует увеличить до 100%. Сурфактантная терапия
Введение сурфактанта может быть рекомендовано.
Профилактически в первые 20 мин жизни всем детям, родившимся на сроке гестации 26 нед и менее при отсутствии у них полного курса антенатальной профилактики стероидами и/или невозможности проведения неинвазивной респираторной терапии в родильном зале (А).
Всем детям гестационного возраста
Недоношенным детям гестационного возраста >30 нед, потребовавшим интубации трахеи в родильном зале. Наиболее эффективное время введения - первые два часа жизни.
Недоношенным детям на стартовой респираторной терапии методом искусственной вентиляции лёгких постоянным положительным давлением в родильном зале при потребности в FiO2 0,5 и более для достижения SpO2 85% к 10-й минуте жизни и отсутствии регресса дыхательных нарушений и улучшения оксигенации в последующие 10-15 мин. К 20-25-й минуте жизни нужно принять решение о введении сурфактанта или о подготовке к транспортировке ребенка в режиме искусственной вентиляции лёгких постоянным положительным давлением. Детям, родившимся на сроке гестации
В отделении реанимации детям, родившимся на сроке 3 баллов в первые 3-6 ч жизни и/или потребности в FiO2 до 0,35 у пациентов 1000 г (В). Повторное введение показано.
Детям гестационного возраста
Детям гестационного возраста
Повторное введение следует проводить только после рентгенографии органов грудной клетки. Третье введение может быть показано детям на искусственной вентиялции легких с тяжелым респераторным дистресс-синдромом (А). Интервалы между введениями 6 часов, однако интервал может сокращаться при нарастании у детей потребности в FiO2 до 0,4 Противопоказания:
- профузное легочное кровотечение (можно вводить после купирования при наличии показаний);
- пневмоторакс.
Методы введения сурфактанта
В родильном зале могут использоваться два основных метода введения: традиционный (через интубационную трубку) и «неинвазивный» или «малоинвазивный».
Сурфактант можно вводить через интубационную трубку с боковым портом или при помощи катетера, введенного в обычную, однопросветную интубацион-ную трубку. Ребенок укладывается строго горизонтально на спину. Под контролем прямой ларингоскопии проводится интубация трахеи. Необходимо проконтролировать симметричность аускультативнои картины и отметку длины интубационной трубки у угла рта ребенка (в зависимости от предполагаемои массы тела). Через боковой порт интубационнои трубки (без размыкания контура искусственной вентиляции легких) ввести сурфактант быстро, болюсно. При использовании техники введения при помощи катетера необходимо измерить длину интубационной трубки, отрезать стерильными ножницами катетер на 0,5-1 см короче длины ЭТТ, проверить глубину расположения ЭТТ выше бифуркации трахеи. Ввести сурфактант через катетер быстро болюсно. Болюсное введение обеспечивает наиболее эффективное распределение сурфактанта в легких. У детеи с массой тела менее 750 г допустимо разделить препарат на 2 равные части, которые следует ввести одну за другои с интервалом в 1-2 мин. Под контролем SpO2 следует снизить параметры искусственной вентиляции легких, в первую очередь давление на вдохе. Снижение параметров следует проводить быстро, так как изменение эластических свойств легких после введения сурфак-танта происходит уже в течение нескольких секунд, что может спровоцировать гипероксическии пик и венлитятор-ассоциированное повреждение легких. В первую очередь следует снизить давление на вдохе, затем (при необходимости) - концентрацию дополнительного кислорода до минимально достаточных цифр, необходимых для достижения SpO2 91-95%. Экстубация как правило проводится после транспортировки пациента в при отсутствии противопоказаний.Неинвазивный метод введения сурфактанта может быть рекомендован к использованию у детей, родившихся на сроке гестации 28 нед и менее (В). Этот метод позволяет избежать интубации трахеи, снизить потребность в проведении инвазивной искусственной вентиляции легких у глубоко недоношенных и, как следствие, минимизировать ИВЛ-ассоциированное повреждение легких. Использование нового метода введения сурфактанта рекомендуется после отработки навыка на манекене.
«Неинвазивный метод» проводится на фоне самостоятельного дыхания ребенка, респираторная терапия которому осуществляется методом режима искусственной вентиляции лёгких постоянным положительным давлением. В положении ребенка на спине или на боку на фоне режима искусственной вентиляции лёгких постоянным положительным давлением (осуществляемого чаще через назофарингеальную трубку) под контролем прямой ларингоскопии следует ввести тонкий катетер (возможно использование щипцов Magill для заведения тонкого катетера в просвет трахеи). Кончик катетера должен быть введен на 1,5 см ниже голосовых связок. Далее под контролем уровня SpO2 следует ввести сурфактант в легкие болюсно медленно, в течение 5 мин, контролируя аускультативную картину в легких, аспират из желудка, SpO2 и частоту сердечных сокращений. Во время введения сурфактанта продолжается респираторная терапия искусственной вентиляции лёгких постоянным положительным давлением. При регистрации апноэ, брадикардии следует временно прекратить введение и возобновить после нормализации уровня частоты сердечных сокращений и дыхания. После введения сурфактанта и извлечения зонда следует продолжить режим искусственной вентиляции лёгких постоянным положительным давлением или неинвазивную искусственную вентиляцию легких.
В отделении реанимации новорожденных детям на режим искусственной вентиляции лёгких постоянным положительным давлением при наличии показаний к введению сурфактанта рекомендуется введение сурфактанта методом INSURE. Метод заключается в интубации пациента под контролем прямой ларингоскопии, верификации положения интубационной трубки, быстром болюсном введении сурфактанта с последующей быстрой экстубации и переводе ребенка на неинвазивную респираторную поддержку. Метод INSURE может быть рекомендован к использованию у детей, родившихся на сроке более 28 недель.
Препараты сурфактанта и дозы
Препараты сурфактанта не одинаковы по своей эффективности. Режим дозирования влияет на исходы лечения. Рекомендуемая стартовая дозировка составляет 200 мг/кг. Данная дозировка является более эффективной, чем 100 мг/кг и приводит к наилучшим результатам лечения недоношенных с респераторным дистресс-синдромом (А). Повторная рекомендуемая доза сурфактанта не менее 100 мг/кг. Порактант-α является препаратом с наибольшей концентрацией фосфолипидов в 1 мл раствора.
Основные методы респираторной терапии респераторного дистресс-синдрома новорожденных
Задачи респираторной терапии у новорожденных с респераторным дистресс-синдромом:
- поддержать удовлетворительный газовый состава крови и кислотно-основное состояние:
- раО2 на уровне 50-70 мм рт.ст.
- SpO2 - 91-95% (В),
- раСО2 - 45-60 мм рт.ст.,
- рН - 7,22-7,4;
- купировать или минимизировать дыхательные нарушения;
Применение режима искусственной вентиляции лёгких постоянным положительным давлением и неинвазивной искусственной вентиляции легких в терапии респираторного дистресс-синдрома новорожденных. В качестве оптимального стартового метода неинвазивной респираторной поддержки, в особенности после введения сурфактанта и/или после экстубации в настоящее время используется неинвазивная искусственная вентиляция легких, осуществляемая через назальные канюли или назальную маску. Использование неинвазивной искусственной вентиляци легких после экстубации в сравнении с режимом искусственной вентиляции лёгких постоянным положительным давлением, а так же после введения сурфактанта приводит к меньшей потребности в реинтубации, меньшей частоты апноэ (В). Неинвазивная назальная искусственная вентиляция легких имеет преимущество перед режимом искусственной вентиляции лёгких постоянным положительным давлением в качестве стартовой респираторной терапии у недоношенных с очень и экстремально низкой массой тела. Регистрация частоты дыхания и оценка по шкале Сильвермана/Доунс проводится до начала режима искусственной вентиляции лёгких постоянным положительным давлением и каждый час проведения режима искусственной вентиляции лёгких постоянным положительным давлением.
Показания:
- в качестве стартовой респираторная терапия после профилактического малоин-вазивного введения сурфактанта без интубации
- в качестве респираторной терапии у недоношенных после экстубации (в том числе и после метода INSURE).
- апноэ, резистентные к терапии искусственной вентиляции лёгких постоянным положительным давлением и кофеином
- нарастание дыхательных нарушений по шкале Сильвермана до 3 и более баллов и/или увеличение потребности в FiO2 >0,4 у недоношенных на режим искусственной вентиляции лёгких постоянным положительным давлением.
Противопоказания: шок, судороги, легочное кровотечение, синдром утечки воздуха, срок гестации более 35 недель.
Стартовые параметры:
- PIP 8-10 см Н2О;
- PEEP 5-6 см Н2О;
- частота 20-30 в минуту;
- время вдоха 0,7-1,0 секунда.
Снижение параметров: при использовании неинвазивной искусственной вентиляции легких для терапии апноэ - производится снижение частоты искусственных вдохов. При использовании неинвазивной искусственной вентиляции легких для коррекции дыхательных нарушений - производится снижение PIP. И в том и в другом случае осуществляется перевод с неинвазивной искусственной вентиляции легких на режим искусственной вентиляции лёгких постоянным положительным давлением, с постепенной отменой дыхательной поддержки.
Показания для перевода с неинвазивной искусственно йвентиляцией легких на традиционную искусственную вентиляцию легких:
- paCO2 >60 мм рт.ст., FiО2>0,4;
- оценка по шкале Сильвермана 3 и более баллов;
- апноэ, повторяющиеся более 4 раз в течение часа;
- синдром утечки воздуха, судороги, шок, легочное кровотечение.
При отсутствии аппарата неинвазивной искусственной вентиляции легких в качестве стартового метода не-инвазивной респираторнои поддержки предпочтение отдается методу спонтанного дыхания под постоянным положительным давлением в дыхательных путях через назальные канюли. У глубоко недоношенных новорожденных использование устройств искусственной вентиляции лёгких постоянным положительным давлением с вариабельным потоком имеет некоторое преимущество перед системами с постоянным потоком, как обеспечивающие наименьшую работу дыхания у таких пациентов. Канюли для проведения метода искусственной вентиляции лёгких постоянным положительным давлением должны быть максимально широкие и короткие (А). Респираторная поддержка методом искусственной вентиляции лёгких постоянным положительным давлением у детеи с ЭНМТ осуществляется на основании алгоритма, представленного ниже.
Определение и принцип действия. Режим искусственной вентиляции лёгких постоянным положительным давлением - continuous positive airway pressure - постоянное (то есть непрерывно поддерживаемое) положительное давление в дыхательных путях. Препятствует спаданию альвеол и развитию ателектазов. Постоянное положительное давление увеличивает функциональную остаточную емкость легких (ФОЕ), снижает резистентность дыхательных путей, улучшает растяжимость легочной ткани, способствует стабилизации и синтезу эндогенного сурфактанта. Может являться самостоятельным методом респираторной поддержки у новорожденных с сохраненным спонтанным дыханием
Показания у новорожденных с респираторным дистресс-синдромом к поддержке спонтанного дыхания с помощью назального режима искусственной вентиляции лёгких постоянным положительным давлением:
- профилактически в родильном зале у недоношенных детей гестационного возраста 32 нед и менее;
- оценки по шкале Сильвермана 3 и более баллов у детей гестационного возраста старше 32 нед с самостоятельным дыханием.
К противопоказаниям относят: шок, судороги, легочное кровотечение, синдром утечки воздуха. Осложнения режима искусственной вентиляции лёгких постоянным положительным давлением.
Синдром утечки воздуха. Профилактикой этого осложнения является как своевременное снижение давления в дыхательных путях при улучшении состояния пациента; своевременный переход на искусственную вентиляцию легких при ужесточении параметров режима искусственной вентиляции лёгких постоянным положительным давлением.
Баротравма пищевода и желудка. Редко встречающееся осложнение, возникающее у недоношенных при неадекватной декомпрессии. Использование желудочных зондов с большим просветом позволяет предотвратить данное осложнение.
Некроз и пролежни носовой перегородки. При правильном наложении назальных канюль и правильном уходе это осложнение встречается крайне редко.
Практические советы по уходу за ребенком на режим искусственной вентиляции лёгких постоянным положительным давлением и на неинвазивной искусственной вентиляции легких.
Необходимо использовать носовые канюли соответствующего размера для предотвращения потери положительного давления.
Шапочка должна закрывать лоб, уши и затылок.
Ленточки, фиксирующие носовые канюли, должны крепиться на шапочке «сзади наперед», чтобы было удобнее усиливать или ослаблять крепление.
У детей массой тела менее 1000 г между щекой и фиксирующей лентой необходимо подкладывать мягкую прокладку (можно вату):
Канюли должны плотно входить в носовые отверстия и держаться без всякой поддержки. Они не должны давить на нос ребенка.
В процессе лечения иногда приходится переходить на канюли большего размера в связи с увеличением диаметра наружных носовых ходов и невозможностью поддерживать в контуре устойчивое давление.
Нельзя санировать носовые ходы из-за возможной травматизации слизистой и быстрого развития отека носовых ходов. Если в носовых ходах имеется отделяемое, то нужно по 0,3 мл раствора натрия хлорида 0,9% влить в каждую ноздрю и санировать через рот.
Температура увлажнителя устанавливается 37 градусов С.
Пространство за ушами следует ежедневно осматривать и протирать влажной салфеткой.
Пространство около носовых отверстий должно быть сухим во избежание воспаления.
Носовые канюли следует менять ежедневно.
Камера увлажнителя и контур должны меняться еженедельно.
Традиционная искусственная вентиляция легких:
Задачи традиционной искусственной вентиляции легких:
- протезировать функцию внешнего дыхания;
- обеспечить удовлетворительную оксигенацию и вентиляцию;
- не повреждать при этом легкие.
Показание для традиционной искусственной вентиляции легких:
- оценка по шкале Сильвермана 3 и более баллов у детей на неинвазивной искусственной вентиляции легких/режима искусственной вентиляции лёгких постоянным положительным давлением;
- потребность в высоких концентрациях кислорода у новорожденных на режим искусственной вентиляции лёгких постоянным положительным давлением/неинвазивной искусственной вентиляции легких (FiO2 >0,4);
- шок, выраженные генерализованные судороги, частые апноэ на неинвазивной респираторной терапии, легочное кровотечение.
Проведение искусственно йвентиляции легких у недоношенных с респираторным дистресс-синдромом основано на концепции минимальнои инвазивности, включающей в себя два положения: использование стратегии «защиты легких» и по возможности быстрый перевод на неинвазивную респираторную терапию.
Стратегия «защиты легких» заключается в поддержании альвеол в расправленном состоянии на всем протяжении дыхательнои терапии. С этои целью устанавливается РЕЕР 4-5 см Н2О. Второй принцип стратегии «защиты легких» заключается в дотации минимально достаточного дыхательного объема, что предотвращает волюмтравму. Для этого следует подбирать пиковое давление под контролем дыхательного объема. Для корректнои оценки используется дыха-тельныи объем выдоха, так как именно он участвует в газообмене. Пиковое давление у недоношенных новорожденных с респираторным дистресс-синдромом подбирается таким образом, чтобы дыхательный объем выдоха был 4-6 мл/кг.
После установки дыхательного контура и калибровки аппарата искусственной вентиляции легких следует выбрать режим вентиляции. У недоношенных новорожденных, у которых сохранено самостоятельное дыхание, предпочтительно использовать триггерную искусственную вентиляцию легких, в частности, режим assist/control. В этом режиме каждыи вдох будет поддерживаться респиратором. Если самостоятельное дыхание отсутствует, то режим А/С автоматически становится режимом принудительной вентиляции - IMV при установке определенной аппаратнои частоты дыхания.
В редких случаях режим А/С может оказываться избыточным для ребенка, когда несмотря на все попытки оптимизировать параметры, ребенок имеет стоикую гипокапнию в связи тахипноэ. В этом случае можно перевести ребенка в режим SIMV и установить желаемую частоту респиратора. У новорожденных, родившихся на 35-й неделе гестации и более целесообразно использовать режим принудительной вентиляции в остром периоде (IMV) или SIMV, если тахипноэ не выражено. Имеются данные о преимуществе использования режимов искусственной вентиляции легких с контролем по объему в сравнении с более распространенными методами искусственной вентиляци легких с контролем по давлению (B). После того как режимы выбраны, до подключения ребенка к аппарату устанавливаются стартовые параметры искусственной вентиляции легких.
Стартовые параметры искусственной вентиляции легких у маловесных пациентов:
- FiO2 - 0,3-0,4 (обычно на 5-10% больше чем при режиме искусственной вентиляции лёгких постоянным положительным давлением);
- Тin - 0,3-0,4 с;
- РееР- +4-5 см вод.ст.;
- ЧД - в режиме assist/control (A/C) частота дыхания определяется пациентом.
Аппаратная частота устанавливается 30-35 и является лишь страховкои на случаи апноэ у пациента. В режиме SIMV и IMV устанавливается частота физиологическая - 40-60 в минуту. PIP обычно устанавливается в диапазоне 14-20 см вод. ст. Поток - 5-7 л/мин при использовании режима «pressure limited». В режиме «pressure control» поток устанавливается автоматически.
После подключения ребенка к аппарату искусственной вентиляции легких проводится оптимизация параметров. FiO2 устанавливается таким образом, чтобы уровень сатурации был в пределах 91-95%. При наличии в аппарате искусственной вентиляции легких функции автоматического подбора FiO2 в зависимости от уровня сатурации у пациента ее целесообразно использовать для профилактики гипоксических и гипероксических пиков, что в свою очередь является профилактикои бронхолегочнои дисплазии, ретинопатии недоношенных, а так же структурных геморрагических и ишемических повреждении головного мозга.
Время вдоха является динамическим параметром. Время вдоха зависит от заболевания, его фазы, от частоты дыхания самого пациента и некоторых других факторов. поэтому при использовании привычной таимциклической вентиляции время вдоха желательно устанавливать под контролем графического мониторинга кривои потока. Устанавливать время вдоха следует так, чтобы на кривои потока выдох являлся бы продолжением вдоха. Не должно быть паузы вдоха в виде задержки крови на изолинии, и в то же время выдох не должен начинаться раньше, чем закончится вдох. при использовании вентиляции, цикличной по потоку время вдоха будет определяться самим пациентом в случае наличия у ребенка самостоятельного дыхания. Такой подход имеет некоторое преимущество, так как позволяет глубоко недоношенному пациенту самому определять комфортное время вдоха. В этом случае время вдоха будет варьировать в зависимости от частоты дыхания пациента, его инспираторной активности. Вентиляция, цикличная по потоку, может использоваться в ситуациях, когда у ребенка присутствует самостоятельное дыхание, нет выраженной экссудации мокроты и отсутствует склонность к ателектазированию. При проведении вентиляции, цикличнои по потоку, необходимо мониторировать фактическое время вдоха пациента. В случае формирования неадекватно короткого времени вдоха, такои пациент должен быть переведен в режим таимциклической искуственной вентиляции легких и вентилироваться с заданным, фиксированным временем вдоха.
Подбор PIP проводится таким образом, чтобы дыхательныи объем выдоха был в диапазоне 4-6 мл/кг. При наличии в аппарате искусственной вентиляции легких функции автоматического подбора пикового давления в зависимости от дыхательного объема пациента, ее целесообразно использовать у тяжело больных пациентов с целью профилактики искусственной вентиляции легких ассоциированного повреждения легких.
Синхронизация ребенка с аппаратом искусственной вентиляции легких. Рутинная медикаментозная синхронизация с респиратором приводит к худшим неврологическим исходам (В). В этой связи необходимо стараться синхронизировать пациента с аппаратом искусственной вентиляции легких адекватным подбором параметров. Подавляющее большинство пациентов с экстремально и очень низкои массои тела при правильно проводимои искус-ственнои вентиляции не требуют медикаментознои синхронизации с аппаратом искусственной вентиляции легких. Как правило, новорожденныи форсированно дышит или «борется» с респиратором, если аппарат искусственной вентиляции легких не обеспечивает ему адекватную минутную вентиляцию. Как известно, минутная вентиляция равна произведению дыхательного объема на частоту. Таким образом, синхронизировать пациента с аппаратом искусственной вентиляции легких можно увеличив частоту респиратора или дыхательный объем, в случае если последнии не превышает 6 мл/кг. Выраженныи метаболическии ацидоз также может являться причинои форсированного дыхания, что требует коррекции ацидоза, а не седации пациента. Исключением могут являться структурные церебральные повреждения, при которых одышка имеет центральныи генез. Если регулировкои параметров не удается синхронизировать ребенка с респиратором, назначают обезболивающие и седативные препараты - морфин, фентанил, диазепам в стандартных дозах.Регулировка параметров искусственной вентиляции легких. Основная коррекция параметров вентиляции заключается в своевременном снижении или повышении пикового давления в соответствии с изменениями дыхательного объема (Vt). Следует поддерживать Vt в пределах 4-6 мл/кг, увеличивая или уменьшая PIP. Превышение этого показателя приводит к повреждению легких и увеличению сроков пребывания ребенка на аппарате искусственной вентиляции легких.
При регулировке параметров необходимо помнить, что:
- основными агрессивными параметрами искусственной вентиляции легких, которые следует снижать в первую очередь, являются: PIP (Vt). и FiC2 (>40%);
- за один раз давление меняется не более чем на 1-2 см вод.ст., а частота дыхания не более чем на 5 вдохов (в режиме SIMV и IMV). В режиме Assist control изменение частоты бессмысленно, так как в этом случае частота вдохов определяется пациентом, а не аппаратом искусственной вентиляции легких;
- FiO2 следует менять под контролем SpO2 ступенчато на 5-10%;
- гипервентиляция (рCO2
Динамика режимов искусственной вентиляции легких. Если не удается экстубировать пациента с режима assist control в первые 3-5 сут, то следует перевести ребенка в режим SIMV с под-держкои давлением (PSV). Этот маневр позволяет уменьшить суммарное среднее давление в дыхательных путях и таким образом снизить инвазивность искусственной вентиляции легких. Таким образом, заданная частота вдохов пациента будет осуществляться с давлением на вдохе, устанавливаемым таким образом, чтобы дыхательный объем был в пределах 4-6 мл/кг. Давление поддержки остальных спонтанных вдохов (PSV) следует устанавливать таким образом, чтобы дыхательныи объем соответствовал нижнеи границе - 4 мл/кг. Т.е. вентиляция в режиме SIMV+PSV проводится с двумя уровнями давления на вдохе - оптимальным и поддерживающим. Уход от искусственной вентиляции легких осуществляется путем снижения принудительнои частоты респиратора, что ведет к постепенному переводу ребенка на режим PSV, с которого и осуществляется экстубация на неинвазивную вентиляцию.
Экстубация. В настоящее время доказано, что наиболее успешная экстубация новорожденных осуществляется при переводе их с искусственной вентиляции легких на режим искусственной вентиляции лёгких постоянным положительным давлением и на неинвазивную искусственную вентиляцию легких. Причем успех при переводе на неинвазивную искусственную вентиляцию легких выше, чем просто экстубация на режим искусственной вентиляции лёгких постоянным положительным давлением.
Быстрая экстубация с режима А/С непосредственно на режим искусственной вентиляции лёгких постоянным положительным давлением или на неинвазивную вентиляцию может осуществляться при следующих условиях:
- отсутствие легочного кровотечения, судорог, шока;
- PIP
- FiO2 ≤0,3;
- наличие регулярного самостоятельного дыхания.Газовый состав крови перед экстубацией должен быть удовлетворительным.
При использовании режима SIMV постепенно снижается FiO2 до величин менее 0,3, PIP до 17-16 см Н2О и ЧД до 20-25 в мин. Экстубация на биназальный режим искусственной вентиляции лёгких постоянным положительным давлением осуществляется при наличии самостоятельного дыхания.
Для успешной экстубации маловесных пациентов рекомендуется использовать кофеин с целью стимуляции регулярного дыхания и предотвращения апноэ. Наибольший эффект от назначения метилксантинов отмечается у детей
Короткий курс малых доз кортикостероидов может быть использован для более быстрого перевода с инвазивной искусственной вентиляцией легких на режим искусственной вентиляции легких постоянным положительным давлением/неинвазивную искусственную вентиляцию легких, если не удается снять недоношенного ребенка с искусственной вентиляцией легких спустя 7-14 дней (А)Необходимый мониторинг.
Параметры искусственной вентиляциии легких:
- FiO2, ЧД (принудительная и спонтанная), время вдоха PIP, РЕЕР, МАР. Vt, процент утечки.
Мониторинг газов крови и кислотно-основного состояния. Периодическое определение газов крови в артериальной, капиллярной или венознои крови. Постоянное определение оксигенации: SpO2 и ТсСO2. У тяжело больных пациентов и у пациентов на высокочастотной искусственной вентиляцией легких рекомендуется постоянныи мониторинг ТсСО2 и ТсО2 с помощью транскутанного монитора.
Мониторинг гемодинамики.
периодическая оценка данных рентгенограммы органов грудной клетки.
Высокочастотная осцилляторная искусственная вентиляция легких
Определение. Высокочастотной осцилляторной искусственной вентиляцией легких называется механическая вентиляция малыми дыхательными объемами с высокой частотой. Легочный газообмен при искусственной вентиляции легких осуществляется за счет различных механизмов, основными из которых являются прямая альвеолярная вентиляция и молекулярная диффузия. Чаще всего в неонатальной практике используется частота высокочастотной осцилляторной искусственной вентиляции легких от 8 до 12 герц (1 Гц = 60 колебаний в секунду). Отличительной чертой осцилляторной искусственной вентиляции легких является наличие активного выдоха.
Показания к высокочастотной осцилляторной искусственной вентиляции легких.
Неэффективность традиционной искусственной вентиляции легких. Для поддержания приемлемого газового состава крови необходимо:
- МАР >13 см вод. ст. у детей с м.т. >2500 г;
- МАР >10 см вод. ст. у детей с м.т. 1000-2500 г;
- МАР >8 см вод. ст. у детей с м.т.
Тяжелые формы синдрома утечки воздуха из легких (пневмоторакс, интерстициальная легочная эмфизема).
Стартовые параметры высокочастотной осцилляторной искусственной вентиляции легких при респираторном дистресс-синдроме новорожденного.
Paw (МАР) - среднее давление в дыхательных путях, устанавливается на 2-4 см вод.ст., чем при традиционной искусственной вентиляции легких.
ΔΡ - амплитуда осцилляторных колебаний, обычно подбирается таким образом, чтобы у пациента определялась видимая на глаз вибрация грудной клетки. Стартовая амплитуда осцилляторных колебаний может быть так же вычислена по формуле:
Где m - масса тела пациента в килограммах.
Fhf - частота осцилляторных колебаний (Гц). Устанавливается 15 Гц для детей массой менее 750 г, и 10 Гц - для детей массой более 750 г. Tin% (процентное отношение времени вдоха) - На аппаратах, где этот параметр регулируется, всегда устанавливается 33% и не меняется на всем протяжении респираторной поддержки Увеличение этого параметра приводит к появлению газовых ловушек.
FiO2 (фракция кислорода). Устанавливается такой же, как при традиционной искусственной вентиляции легких.
Flow (постоянный поток). На аппаратах с регулируемым потоком, устанавливается в пределах 15 л/мин ± 10% и в дальнейшем не изменяется.
Регулировка параметров. Оптимизация объема легких. При нормально расправленных легких купол диафрагмы должен располагаться на уровне 8-9 ребра. Признаки гиперинфляции (перераздувание легких):
- повышенная прозрачность легочных полей;
- уплощение диафрагмы (легочные поля распространяются ниже уровня 9 ребра).
Признаки гипоинфляции (недорасправленные легкие):
- рассеянные ателектазы;
- диафрагма выше уровня 8 ребра.
Коррекция параметров высокочастотной осцилляторной искусственной вентиляции легких, основанная на показателях газов крови.
При гипоксемии (раО2
- увеличить МАР по 1-2 см вод. ст.;
- увеличить FiO2 на 10%.
При гипероксемии (раО2 >90 мм рт.ст.):
- уменьшить FiO2 до 0,3.
При гипокапнии (раСО2
- уменьшить ДР на 10-20%;
- увеличить частоту (на 1-2 Гц).
При гиперкапнии (раСО2 >60 мм рт.ст.):
- увеличить ΔР на 10-20%;
- снизить частоту осцилляций (на 1-2 Гц).
Прекращение высокочастотной осцилляторной искусственной вентиляции легких
При улучшении состояния больного постепенно (с шагом 0,05-0,1) уменьшают FiO2, доводя его до 0,3. Также ступенчато (с шагом 1-2 см вод. ст.) снижают МАР до уровня 9-7 см вод. ст. Затем ребенка переводят либо на один из вспомогательных режимов традиционной вентиляции, либо на неинвазивную респираторную поддержку.
Особенности ухода за ребенком на высокочастотной осцилляторной искусственной вентиляции легких
Для адекватного увлажнения газовой смеси рекомендуется постоянное капельное введение стерильной дистиллированной воды в камеру увлажнителя. Из-за высокой скорости потока жидкость из увлажнительной камеры испаряется очень быстро. Санацию дыхательных путей следует проводить только при наличии:
- ослабления видимых колебаний грудной клетки;
- значительного увеличения рСО2;
- снижения оксигенации;
- время отсоединения дыхательного контура для санации не должно превышать 30 с. Желательно использовать закрытые системы для санации тра-хеобронхиального дерева.
После завершения процедуры следует временно (на 1-2 мин) увеличить PAW на 2-3 см вод.ст.
Нет необходимости вводить миорелаксанты всем детям, находящимся на ВЧО ИВЛ. Собственная дыхательная активность способствует улучшению оксигена-ции крови. Введение миорелаксантов приводит к увеличению вязкости мокроты и способствует развитию ателектазов.
Показания к назначению седативных препаратов включают выраженное возбуждение и выраженные дыхательные усилия. Последнее требует исключение гиперкарбии или обтурации эндотрахеальной трубки.
Дети на высокочастотной осцилляторной искусственной вентиляции легких требуют более частого проведения рентгенологического исследования органов грудной клетки, чем дети на традиционной искусственной вентиляции легких.
Высокочастотную осцилляторную искусственную вентиляцию легких целесообразно проводить под контролем транскутанного pCO2
Антибактериальная терапия
Антибактериальная терапия при респираторном дистресс-синдроме не показана. Однако в период проведения дифференциальной диагностики респираторного дистресс-синдрома с врожденной пневмонией/врожденным сепсисом, проводимой в первые 48-72 ч жизни, целесообразно назначение антибактериальной терапии с последующей быстрой ее отменой в случае получения отрицательных маркеров воспаления и отрицательного результата микробиологического посева крови. Назначение антибактериальной терапии на период проведения дифференциальной диагностики может быть показано детям с массой тела менее 1500 г, детям на инвазивной искусственной вентиляции легких, а так же детям, у которых результаты маркеров воспаления, полученные в первые часы жизни, сомнительны. Препаратами выбора может являться сочетание антибиотиков пенициллинового ряда и аминогликозидов или один антибиотик широкого спектра из группы защищенных пенициллинов. Не следует назначать амоксициллин + кла-вулановую кислоту в связи с возможным неблагоприятным воздействием кла-вулановой кислоты на кишечную стенку у недоношенных.
Стенозирующий ларингит, синдром крупа
Круп - это остро возникшее нарушение дыхания, обычно на фоне невысокой температуры (чаще всего - инфекция вирусом парагриппа). При крупе затруднен вдох (инспираторная одышка).
Признаки крупа
Осиплость голоса, лающий , шумное дыхание на вдохе (инспираторный стридор). Признаки тяжести - выраженное втяжение яремной ямки и межреберий, снижение уровня кислорода в крови. Круп III-й степени требует неотложной интубации, круп I-II степени лечится консервативно. Следует исключить эпиглоттит (см. ниже).
Обследование при крупе
Измерение насыщения крови кислородом - пульсоксиметрия. Тяжесть крупа иногда оценивают по шкале Westlеy (табл. 2.2).
Таблица 2.1. Шкала оценки степени тяжести крупа Westley
| Выраженность симптома | Баллы* |
| Стридор (шумное дыхание) | |
| Отсутствует | 0 |
| При возбуждении | 1 |
| В покое | 2 |
| Втяжение уступчивых мест грудной клетки | |
| Отсутствует | 0 |
| Легкое | 1 |
| Умеренно выраженное | 2 |
| Резко выраженное | 3 |
| Проходимость дыхательных путей | |
| Нормальная | 0 |
| Нарушена умеренно | 1 |
| Значительно снижена | 2 |
| Цианоз | |
| Отсутствует | 0 |
| При двигательной активности | 4 |
| В покое | 5 |
| Сознание | |
| Без изменений | 0 |
| Нарушения сознания | 5 |
| * менее 3 баллов - легкая степень, 3-6 баллов - средне-тяжелая, более 6 баллов - тяжелая степень. | |
Лечение крупа
Большинство случаев ларингита и крупа вызываются вирусами и в антибиотиках не нуждаются. Назначают будесонид (Пульмикорт) в ингаляциях 500-1000 мкг на 1 ингаляцию (возможно, вместе с бронхолитиками сальбутамолом или комбинированным препаратом Беродуал - ипратропия бромид + фенотерол), в более тяжелых случаях, при отсутствии эффекта от ингаляции или при повторном развитии крупа, вводят внутримышечно дексаметазон 0,6 мг/кг. По эффективности ингаляционный и системный глюкокортикостероид (ГКС) одинаковы, однако детям до 2 лет лучше начинать лечение с системных препаратов. При необходимости используют кислород увлажненный, сосудосуживающие капли в нос.
Важно!!! Вирусный круп хорошо поддается лечению глюкокортикоидами и больших терапевтических проблем не представляет. У больного со стенозом гортани важно сразу исключить эпиглоттит.
Эпиглоттит
Эпиглоттит - это воспаление надгортанника. Чаще вызывается Н. influenzae типа b, реже пневмококком, в 5% случаев - S. aureus, характеризуется высокой температурой и интоксикацией. От вирусного крупа его отличают отсутствие катара, кашля, осиплости голоса, наличие боли в горле, ограничение подвижности челюсти (тризм), поза «треножника», усиленное слюноотделение, а также широко открытый рот, шумное дыхание на вдохе, западение надгортанника в положении на спине, лейкоцитоз > 15х10 9 /л. Ингаляции Пульмикортом, введение преднизолона или дексаметазона не приносят существенного облегчения.
Важно!!! Осмотр ротоглотки проводится только в условиях операционной под общей анестезией, в полной готовности интубировать ребенка.
Рентгенография шеи в боковой проекции, рекомендуемая рядом авторов, оправданна только при неуверенности в диагнозе, т. к. в 30-50% случаев она не выявляет патологию. Определение газов крови для диагностики необязательно: при подозрении на эпиглоттит любые манипуляции, кроме жизненно важных, нежелательны. Достаточно сделать анализ крови, определить СРБ, выполнить пульсоксиметрию.
Для дифференциальной диагностики вирусного крупа и эпилоттита используется приведенный в табл. 2.3 набор признаков.
Таблица 2.3. Дифференциально-диагностические критерии эпиглоттита и вирусного крупа (по DeSoto Н., 1998, с изменениями)
| Эпиглоттит | Круп | |
| Возраст | Любой | Чаще от 6 месяцев до 6 лет |
| Начало | Внезапное | Постепенное |
| Локализация стеноза | Над гортанью | Под гортанью |
| Температура тела | Высокая | Чаще субфебрильная |
| Интоксикация | Выраженная | Умеренная или отсутствует |
| Дисфагия | Тяжелая | Отсутствует или легкая |
| Боль в горле | Выраженная | Умеренная или отсутствует |
| Нарушение дыхания | Есть | Есть |
| Кашель | Редко | Специфический |
| Положение пациента | Сидит прямо, с открытым ртом | Любое |
| Рентгенологические признаки | Тень увеличенного надгортанника | Симптом «шпиля» |
Лечение эпиглоттита
Внутривенно цефотаксим 150 мг/кг в сутки (или цефтриаксон 100 мг/кг в сутки) + аминогликозид. Цефотаксим детям до 2,5 лет внутримышечно не водят из-за болезненности. При неэффективности (стафилококк!) - внутривенно клиндамицин 30 мг/кг/сут или ванкомицин 40 мг/кг в сутки. Показана ранняя интубация (профилактика внезапной асфиксии). Экстубация безопасна после нормализации температуры, прояснения сознания и стихания симптомов, обычно через 24-72 часов (до экстубации - осмотр через гибкий эндоскоп). Эпиглоттит часто сопровождается бактериемией, что увеличивает длительность лечения.
Важно!!! При эпиглоттите запрещается: ингалировать, осуществлять седацию, провоцировать беспокойство!