Оксидативный стресс сперматозоидов (АФК\ROS тест). Применение комплекса нутриентов для лечения мужского бесплодия Продукция афк отмытыми сперматозоидами
Нами исследована продукция АФК нейтрофилами (Нф) и моноцитами(Мн) с помощью тестов люминолзависимой и люцигенинзависимой (спонтанной и индуцированной убитым стафилококком) хемилюминесценции (ХЛ), отражающих соответственно продукцию высокотоксичных активных форм кислорода (АФК) в системе миелопероксидазы и супероксиданиона у 66 больных СКВ, а также у 22 здоровых доноров. Средний возраст больных СКВ составлял 41,4±10,9 года, длительность процесса соответственно 11±4 года. Минимальная степень активности воспалительного процесса (А1) диагностирована у 41 больного (62,1%), умеренная (АII) - у 25 (37,9%). Острое течение заболевания встречалось у единичных больных (данные их обследования не включены в настоящую работу), подострое течение - у 38 (57,6%), хроническое - у 28 (42,4%). Суставной синдром при СКВ встречался у 49 больных (74,2%).
У больных СКВ, как при наличии, так и при отсутствии поражения суставов, продукция АФК, как Нф, так и Мн, по данным тестов спонтанной люцигенин- и люминолзависимой ХЛ была увеличена по сравнению с показателями группы контроля, характеризуясь выработкой широкого спектра АФК, в том числе высокотоксичных, с мощным гистодеструктивным действием. Индуцированные тесты ХЛ характеризовались вариабельностью, а коэффициенты активации фагоцитов при обеих формах красной волчанки, как правило, были уменьшены, указывая на снижение резервных функций циркулирующих фагоцитов.
При сравнении исследуемых показателей у больных СКВ в зависимости от наличия или отсутствия у них суставного синдрома констатировано снижение индуцированной люцигенинзависимой ХЛ Нф и спонтанной люминолзависимой ХЛ Нф у пациентов с поражениями суставов по сравнению с аналогичными данными в группе больных СКВ с отсутствием суставных поражений.
Проведенные исследования свидетельствуют о повышенной продукции АФК циркулирующими фагоцитами при СКВ, независимо от того, имеются или отсутствуют поражения суставов. Вместе с тем, развитие поражений суставов у больных СКВ сопровождается снижением некоторых показателей окислительного стресса нейтрофилов, что демонстрирует многоликость проявлений окислительного стресса фагоцитов в зависимости от клинических проявлений, в частности, от развития суставных поражений.
Работа представлена на II научную конференцию студентов, молодых ученых и специалистов с международным участием «Современные проблемы науки и образования», 19-26 февраля 2005г. Хургада (Египет)
Библиографическая ссылка
Романова Н.В. ПРОДУКЦИЯ АКТИВНЫХ ФОРМ КИСЛОРОДА ЦИРКУЛИРУЮЩИМИ ФАГОЦИТАМИ И СУСТАВНОЙ СИНДРОМ ПРИ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКЕ // Успехи современного естествознания. – 2005. – № 3. – С. 116-116;URL: http://natural-sciences.ru/ru/article/view?id=8239 (дата обращения: 30.01.2020). Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
Бесплодие – это неспособность сексуально активной супружеской пары, не применяя контрацепции достигнуть беременности в течение более одного года.
Примерно 25% супружеских пар сталкиваются с отсутствием зачатия в течение одного года. Из них 15% проходят лечение по поводу бесплодия.
Мужской фактор занимает примерно 40% среди причин бесплодного брака, в последние десятилетия наблюдается необъяснимое прогрессивное снижение числа сперматозоидов в эякуляте. Примерно 6-8% мужчин являются бесплодными. Около 40% составляет женское бесплодие и 20% смешанное.
Диагностика мужского бесплодия:
Диагностика мужского бесплодия основывается на комплексной оценке состояния мужской репродуктивной системы, врач андролог проводит обследование в определенной последовательности. Диагностику начинают с минимума и по мере необходимости расширяют.
Минимальный алгоритм обследования мужчины при бесплодии: (этот алгоритм позволяет верифицировать диагноз и выявить нарушения способности к оплодотворению у мужчин, позволяет оценить анатомо-функциональное состояние органов репродуктивной системы).
1. Консультация (сбор анамнеза, жалоб) и осмотр врача андролога.
2. Оценка показателей спермограммы — оценивают мужскую фертильность (качество спермы). Является точкой отсчета необходимости дальнейших действий (анализ сдают путем мастурбации в отдельно отведенном помещении, перед этим 3 дня воздержания от половых контактов, не пить алкоголь, не посещать баню). Виды патоспермии.
3. MAR-тест – исключают иммунное бесплодие (подготовка такая же как и при сдачи спермограммы).
4. УЗИ + Допплерометрия органов мошонки – исследование яичек, придатков и кровоснабжение этих органов. Исключает хирургическую, воспалительную и физиологическую патологию.
5. ТРУЗИ предстательной железы и семенных пузырьков – более детальное исследование предстательной железы, которое позволяет рассмотреть ее структуру и исключить острые и хронические воспалительные процессы.
Полный алгоритм обследования мужчины при бесплодии: (проводят после минимального алгоритма с целью уточнения диагноза или при наличии жалоб со стороны пациента).
1. Гормональный статус – анализ крови на основные гормоны отвечающие за нормальное протекание сперматогенеза и мужское либидо
2. Генетические исследования – выполняют по назначению врача андролога исходя из клинической ситуации (прямым показанием для исследования является выраженная патоспермия).
3. ПЦР — диагностика инфекций ЗППП – исключают основные инфекции передающиеся половым путем и их возможное влияние на снижение качества спермы и отсутствие зачатия, выкидыш или замирание беременности (мазок из мочеиспускательного канала, за 2 часа до исследования не мочиться).
4. Посев спермы – исследование эякулята выполняют в случаях повышения лейкоцитов или появлении бактерий в сперме (анализ сдают путем мастурбации в стерильный контейнер, воздержание не обязательно).
5. Сок предстательной железы – (секрет простаты) – исключают воспалительный процесс в предстательной железе – простатит (перед анализом обязательно 3 дня полового воздержания).
6. Определение уровня свободных радикалов (ROS) – один из факторов, способный снижать мужскую фертильность ROS — гиперпродукция активных форм кислорода (озон, свободные радикалы, перекись водорода). В небольших количествах АФК необходимы для нормальной регуляции функции сперматозоидов (гиперактивация и акросомальная реакция). Но избыточная продукция АФК приводит к повреждению мембраны сперматозоидов, снижению их подвижности и нарушению оплодотворяющей способности. Кроме того, АФК непосредственно повреждают ДНК хромосом и инициируют апоптоз сперматозоидов.
7. Акросомальная реакция – (это химические изменения на головке сперматозоида, позволяющие проникнуть ему в яйцеклетку)- при контакте сперматозоида с прозрачной областью оболочки яйцеклетки, акросома сперматозоида претерпевает акросомальную реакцию, которая в норме протекает только у морфологически нормальных сперматозоидов и позволяет им проникнуть внутрь яйцеклетки.
8. Электронно-микроскопическое исследование сперматозоидов (NEW) – новый метод более детального изучения и выявления патологических внутренних структур у сперматозоидов и содержимого семенной плазмы.
9. Биохимия эякулята – исследование состава семенной плазмы, отражает работу таких органов как предстательная железа, семенные пузырьки и придатки яичек. (исследуют уровень фруктозы, лимонной кислоты, нейтральной альфа — гликозидазы, простатической кислой фосфатазы, цинка).
10. Исследование морфологии по Крюгеру — более углубленное исследование морфологии сперматозоидов при выполнении обычной спермограммы (выполняют совместно со спермограммой). Рзавернутая спермограмма – в нее входит стандартная спермограмма (показатели рекомендованные ВОЗ) + MAR-тест (IgG; IgA) + морфология по Крюгеру.
11. Проба Курцрока-Миллера; Тест Шуварского — выявление иммунологического конфликта между мужчиной и женщиной на уровне шейки матки (шеечный фактор, посткоитальный тест).
12. HLA – типирование супружеской пары (при не вынашивании беременности). Проводится для определения антигенов тканевой совместимости у супругов. Выполняют забор венозной крови и выделение из нее клеток лейкоцитов, на поверхности которых расположены антигены тканевой совместимости.
13. Диагностическая биопсия яичек – выполняют по назначению врача андролога, в случаях с азооспермией (необходима для постановки точного диагноза и выбора дальнейшей тактики лечения).
14. ПСА – простат специфический антиген, исследование выполняют всем мужчинам старше 45 лет.
15. Лабораторные методы диагностики – назначает врач по показаниям: общий анализ мочи, посев мочи, общий анализ крови, биохимия крови и др.
16. Определение онкомаркеров – назначение выполняет врач по показаниям.
Андрологическая лаборатория
Спермограмма по ВОЗ 2010 1607 p.
Антиспермальные антитела на сперматозоидах (Мар тест непрямой Ig G) 1928 p.
Антиспермальные антитела на сперматозоидах (Мар тест непрямой Ig A) 1928 p.
Антиспермальные антитела на сперматозоидах (Мар тест прямой Ig G) 1499 p.
Антиспермальные антитела на сперматозоидах (Мар тест прямой Ig A) 1499 p.
Посткоитальный тест (тест in vivo) 2142 p.
Тест Курцрока Миллера 2142 p.
Лаборатория клинической андрологии выполняет специальные анализы для мужчин
Все мальчики перед армией в школе проходят медицинский осмотр. Это помогает выявить различные нарушения, в том числе связанные с репродуктивным здоровьем. Редко, когда молодой мужчина в дальнейшем по собственной инициативе обращается к врачу для профилактики. В основном, приходят на обследование, когда уже есть жалобы, либо по инициативе партнерши, либо в законном браке, когда несколько лет не получается зачать ребенка.
Во всех этих случаях, как для профилактики, так и при наличии различных проблем, наша задача – объективно оценить ситуацию, правильно выбрать перечень необходимых анализов, провести исследования и отправить результаты на электронную почту пациента. В дальнейшем пациент при необходимости может обсудить данные этих анализов с врачами урологом-андрологом, или гинекологом-репродуктологом, которые работают в нашей поликлинике.
Основное направление работы лаборатории клинической андрологии – это мужское бесплодие и сочетанные формы мужского и женского бесплодия, а также инфекционно-воспалительные процессы мочеполовой системы мужчины.
Сотрудники лаборатории - врачи, медицинские технологи, лаборанты, - работают вместе уже 6 лет, являются ведущими специалистами по сперматологии в нашей стране. У многих опыт работы в Научном центре акушерства и гинекологии им. В.И.Кулакова, клинике урологии им. Р.М.Фронштейна Первого МГМУ им. И.М. Сеченова, клиники андрологии Российского университета дружбы народов. Лабораторные исследования, выполненные нашими сотрудниками, лежат в основе многих научных работ по андрологии, диссертаций и публикаций, в т.ч. в ведущих англоязычных журналах.
Квалификация, необходимое оснащение и многолетний опыт работы позволяет выполнять различные исследования спермы на экспертном уровне.
Анализы выполняются точно по всем требованиям ВОЗ-2010 года.
Внедрены в клиническую практику самые современные методы оценки функции сперматозоидов: оксидативного стресса, акросомной реакции, фрагментации ДНК, нарушений упаковки хроматина и др.
Все анализы выполняются здесь же в лаборатории, никуда не отвозятся, сразу, как только материал разжижается.
Имеются прекрасные условия для сдачи спермы: отдельная звукоизолированная комната с туалетом и раковиной, большой телевизор. Помещение для сдачи спермы находится непосредственно рядом с лабораторией.
Исследование эякулята (спермы) – основные требования
Исследование спермы - концентрации, подвижности и морфологии сперматозоидов, содержание лейкоцитов, антиспермальных антител, повреждений ДНК, многих других функциональных показателей, - основной метод оценки мужской фертильности.
Несмотря на внедрение компьютерных технологий, исследование спермы, выполненное опытным врачом-лаборантом, по-прежнему самый точный, надежный и воспроизводимый способ диагностики.
Проводить исследование спермы следует в специализированных лабораториях, а не лабораториях общего профиля (тем более не в сетевых лабораториях), поскольку описание большинства параметров спермограммы – подвижность, морфология, МАР-тест и др., - субъективная и в решающей степени зависит от опыта и квалификации врача-лаборанта. В идеале анализ спермы в динамике должен проводить один специалист, поскольку даже при строгом внутреннем контроле качества в лаборатории, расхождения в результатах при выполнении анализа разными врачами могут иметь место.
Сперма – материал непростой. Повышенная вязкость, неполноценная сдача, наличие лейкоцитов, незрелых клеток сперматогенеза, бактерий, различные категории подвижности может правильно определить только врач с большим опытом работы. За последнее время несколько раз менялись нормы ВОЗ по исследованию спермы, и в разных лабораториях стоят разные референсные значения. Так же надо учитывать сезонные колебания показателей спермограммы, состояние пациента на данный момент, его психологические особенности.
Сперму для анализа следует сдавать при половом воздержании от 2 до 7 суток, желательно ближе к привычному ритму сексуальной активности. Исключить алкоголь, не болеть, не париться, не принимать горячую ванну, быть здоровым.
При отклонении показателей спермограммы при первичном обследовании от нормальных, анализ следует повторить через 2-6 нед для подтверждения диагноза. Поскольку сперматогенез – процесс образования зрелого сперматогенеза, - занимает почти 3 мес, любое негативное воздействие (лихорадка, стресс, отравление и др.) может оказывать влияние на качество спермы в течение этого времени.
Необходимо понимать, что даже при большом количестве сперматозоидов, хорошей подвижности, они могут не выполнить свою главную функцию – оплодотворение яйцеклетки, потому что, есть «поломка» на другом уровне. По последним данным, до 30% случаев мужское бесплодие имеет место при «нормозооспермии» - формально нормальной спермограмме. Установление мужского фактора бесплодия требует в этом случае использование специальных функциональных тестов.
Базовыми исследованиями для постановки диагноза «фертилен» или «бесплоден» (может иметь детей или нет), в настоящее время являются:
Спермограмма – определение объема, вязкости, рН спермы, концентрации, подвижности и морфологии сперматозоидов, их агглютинации, количества лейкоцитов и ряда других параметров.
МАR–тест - тест на наличие антиспермальных антител (АСАТ), приводящих к иммунному бесплодию. Различают АСАТ класса IgG и класса IgA, имеющие свои особенности.
Активные формы кислорода (АФК или ROS) в нативном эякуляте (сперме) и на отмытых сперматозоидов. Увеличение продукции активных форм кислорода в нативном эякуляте является чувствительным маркером инфекционно-воспалительного процесса (более чувствительным, чем количество лейкоцитов). Продукция АФК отмытыми сперматозоидами – признак оксидативного стресса половых клеток, при котором страдают даже хромосомы. Оксидативный стресс сперматозоидов – причина не только мужского бесплодия, но невынашивания беременности и врожденных аномалий у детей.
Эти три анализа помогут в постановке правильного диагноза, наметят пути дальнейшего лечения, либо определят необходимость дополнительного исследования при обнаруженных нарушениях.
Необходимо отметить, что каждый день приходят молодые мужчины на сдачу спермограммы и даже не подозревают о наличии гнойного процесса, когда в семенной плазме имеется большое количество лейкоцитов. Это может привести к дальнейшей закупорке семявыносящих путей и в итоге сперматозоиды не выходят наружу или еще хуже, нарушается их процесс формирования. В результате, диагностика фертильности мужчины и инфекционного процесса у нас в лаборатории неразделимы. Только в окрашенных мазках можно увидеть и отличить лейкоциты и незрелые клетки сперматогенеза на разных стадиях развития. И если обнаружен гнойный процесс, то сразу сперму можно исследовать на инфекции передаваемые половым путем и сделать бактериальный посев на аэробы и анаэробы. Так же надо понимать, что воспаление можно обнаружить в сперме, а секрет простаты будет в норме, и наоборот, в секрете простаты может быть воспаление, а в сперме норма. Инфекции передаваемые половым путем исследуют из соскоба, взятого из уретры, для этого пациент должен не мочиться более трех часов. К нам на анализы обращаются мужчины разного возраста для адекватной постановки диагноза «простатит».
Учитывая образ жизни современного молодого мужчины - раннюю половую жизнь, большое количество половых партнерш, секс без барьерной контрацепции, малоподвижный образ жизни, стрессы, - мы рекомендуем профилактически обследоваться не только на инфекции, но и сдавать спермограмму, для контроля рождения здорового потомства.
Автореферат диссертации по медицине на тему Мужская фертильность и генерация активных форм кислорода в семенной жидкости
г 8 с:-: /I
На правах рукописи
ГРОМЕНКО ДМИТРИЙ СЕРГЕЕВИЧ
МУЖСКАЯ ФЕРТИЛЬНОСТЬ И ГЕНЕРАЦИЯ АКТИВНЫХ ФОРМ КИСЛОРОДА В СЕМЕННОЙ ЖИДКОСТИ
14.00.16. - патологическая физиология
диссертации на соискание ученой степени кандидата медицинских наук
Челябинск - 2002
Работа выполнена в Центральной научно-исследовательской лаборатории Башкирского государственного медицинского университета и Центре планирования семьи и репродукции с медико-генетической консультацией Республиканской клинической больницы имени Г.Г.Куватова.
Научный руководитель: доктор медицинских наук,
профессор P.P. ФАРХУТДИНОВ
Научный консультант: доктор медицинских наук,
профессор М.А.НАРТАЙЛАКОВ
Официальные оппоненты: доктор медицинских наук,
профессор С.Б.АРТИФЕКСОВ
доктор медицинских наук, профессор Ю.Н.КОВАЛЕВ
Ведущее учреждение:
САНКТ-ПЕТЕРБУРГСКАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ ПОСЛЕДИПЛОМНОГО ОБРАЗОВАНИЯ
Защита диссертации состоится «__» 2002 г. в__часов на
заседании диссертационного совета Д-208.117-02 в Челябинской государственной медицинской академии по адресу: 454092, г.Челябинск, ул.Воровского, 64.
С диссертацией можно ознакомиться в библиотеке Челябинской государственной медицинской академии.
Ученый секретарь диссертационного совета доктор медицинских наук, профессор
2002 г. Л.В.Кривохижина
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
АКТУАЛЬНОСТЬ ПРОБЛЕМЫ. В последнее время уделяется Зольшое внимание проблемам репродукции, возможности прогнозирования детородной функции у человека. По мнению различных авторов (Тиктинский О,Л., 1999., В.И.Кулаков, Б.В.Леонов, 2000) частота бесплодных браков вставляет 15% - 19%, что отражается на демографических показателях. Примерно в половине случаев бесплодие обусловлено мужским фактором и отмечается дальнейшая тенденция к его увеличению (Felberbraun R., Diedrich ЕС., 1998).
В конце XX начале XXI века во всем мире происходит снижение качества репродуктивного здоровья мужчин (Тер-Аванесов Г.В., Назаренко Т.А., Кулаков В.Й., 2000), Снижение показателей сперматогенеза происходит со скоростью 2% в год при одновременном уменьшении доли подвижных и морфологически полноценных форм сперматозоидов (Auger J. et al., 1995., Irvine S. et al., 1996., Sharpe R.M. et al., 1995). Сперматогенез представляет собой процесс непрерывного деления клеток, наиболее уязвимых для патогенного воздействия неблагоприятных химических, физических и бытовых агентов. Явление снижения сперматогенной функции, по всей вероятности, служит отражением возрастающего воздействия на организм человека повреждающих факторов, встречающихся в окружающей среде, на производстве и бьпу (Быков В.Л., 2000). Выяснение механизмов, повлекших за собой бесплодие, в каждом конкретном случае важно для выбора оптимальной тактики лечения.
Общепринятым для оценки мужской фертильности является изучение параметров эякулята, куда входят макроскопические, микроскопические, биохимические и функциональные критерии. Оценка показателей спермограммы в значительной степени субъективна и зависит от характеристик исследуемого образца: чем выше концентрация сперматозоидов в эякуляте и чем меньше доля прогрессивно подвижных форм, тем менее согласуются результаты разных лаборантов. В ряде случаев низкая частота оплодотворения в культуре является следствием функциональных аномалий сперматозоидов, не выявляемых при анализе традиционных показателей спермограммы (Леонтьева О.А., Воробьева О.В., Козлов В,В., 2000). С другой стороны, стандартные методы диагностики не всегда позволяют судить о причинах изменения функций сперматозоидов (Руководство ВОЗ, 1999). Таким образом, результаты рутинных исследований эякулята недостаточно надежны с клинической точки зрения, так как в ряде случаев фертильность бывает не нарушена при значительных отклонениях спермограммы от нормы, в то время как бесплодие может наблюдаться у мужчин с нормозооспермией (Liu D., Baker H.W.G., 1992).
В последнее время появляются публикации, свидетельствующие о влиянии свободно-радикального окисления (СРО) на процессы репродукции (Conte G., Milandi D., De Marinis L., 1999). В частности, доказана способность сперматозоидов к образованию свободных радикалов (CP), получивших
обобщающее название - активные формы кислорода (АФК): супероксидный анион-радикал, анион-радикал гидроксила, синглентная форма кислорода, перекись водорода и гипохлорит. Проблема действия активных форм кислорода на сперматозоиды в настоящее время мало изучена. Ясно лишь, что избыток активных форм кислорода может оказать негативное влияние на половые клетки (Аккея ВЛ., 1999).
В последнее время для выявления АФК начинают использовать хемилюминесцентные методы с применением специальных индукторов свечения. В качестве индукторов, не влияющих непосредственно на ход процесса, а лишь увеличивающих интенсивность регистрируемой хемилюминесценции (люминофоров), используются люминол, люцигенин, аналоги люциферина. Другой тип индукторов ускоряет процессы свободно-радикального окисления, В частности, к ним относятся ионы металлов переменной валентности, например, соли двухвалентного железа, перекись водорода, перманганат калия, щелочи.
В этой связи теоретический и практический интерес представляют исследования, посвященные выявлению механизмов нарушений репродуктивной функции мужчин, разработке экспресс-методов оценки генерации активных форм кислорода в сперме и определению состояния свободно-радикального окисления в эякуляте.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить состояние свободно-радикального окисления в семенной жидкости при мужском бесплодии.
ЗАДАЧИ ИССЛЕДОВАНИЯ
1. Изучить состояние генерации активных форм кислорода в эякуляте в норме и патологии.
2. Определить уровень суммарной антиокислительной активности спермоплазмьг.
3. Выбрать оптимальные условия определения состояния свободно-радикальиого окисления и антиокислитедьной активности в сперме, основанные на регистрации хемилюминесценции.
4. Клинически обосновать эффективность применения хемшиоминесцентных методов исследования как дополнительного критерия оценки мужской фертильности.
НАУЧНАЯ НОВИЗНА
В результате проведенных исследований разработан экспресс-метод оценки состояния свободно-радикального окисления в эякуляте, заключающийся в определении интегральных показателей суммарной антиокислительной активности спермоплазмы в модельной системе, генерирующей активные формы кислорода, и спонтанного люминолзависимого свечения эякулята.
Уточнены механизмы, приводящие к некоторым формам мужского бесплодия. При мужской инфертильности происходит увеличение генерации
активных форм кислорода функционально неполноценными сперматозоидами при высокой антиокислнтельной активности спермоплазмы.
Определена патогенетическая роль нарушения процессов генерации активных форм кислорода при мужской инфертштьности. Показано, что при идиопатических формах мужского бесплодия происходит повышение генерации активных форм кислорода.
ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ
Предложен, апробирован и внедрен в практическую деятельность врачей-урологов неинвазивный экслресс-метод регистрации хемилюминесценции эякулята для изучения состояния генерации активных форм кислорода и антиокислительной активности спермоплазмы при мужском бесплодии.
С помощью разработанного метода установлены нормативные показатели хемилюминесценции при обследовании мужчин с доказанной фертильностью. В норме эякулят характеризуется низким уровнем свечения и высокой антиокислительной активностью спермоплазмы.
Намечены новые подходы к патогенетическому лечению мужского бесплодия с учетом роли свободно-радикального окисления, заключающиеся в проведении рациональной антиоксидантной терапии, коррекции генерации активных форм кислорода.
АПРОБАЦИЯ РАБОТЫ И ВНЕДРЕНИЕ ЕЁ РЕЗУЛЬТАТОВ В ПРАКТИКУ
Материалы диссертации доложены на:
1. Научно-практическом семинаре Российской ассоциации репродукции человека «Лечение бесплодия: нерешенные проблемы», Саратов, 2001г.;
2. Заседании общества урологов Республики Башкортостан, 2000г. и
3. Секционном заседании «Репродуктивное здоровье мужского населения РБ» съезда врачей акушеров-гинекологов и педиатров Республики Башкортостан, г.Уфа, 2001г.;
4. Республиканской молодежной научной конференции «Вопросы теоретической и практической медицины», г.Уфа, 2001г.;
5. I Международном Конгрессе «Новые медицинские технологии», г. Санкт-Петербург, 2001г.;
6. Национальной научно-практической конференции с международным участием «Свободные радикалы, антиоксиданты и болезни человека», г. Смоленск, 2001г.
7. Семинаре акушеров-гинекологов «Современный взгляд на вагинальные инфекции. Хламидиоз. Кандидоз. Вопросы мужского бесплодия», г.Уфа, 2002г.
Разработанный метод регистрации активных форм кислорода в эякуляте используется для диагностики и определения тактики лечения
мужского бесплодия в Республиканском Центре планирования семьи и репродукции с медико-генетической консультацией г.Уфы. Материалы, полученные в диссертации, введены в учебную программу и включены в курс лекций для студентов Башкирского государственного медицинского университета, а также курсантов института последипломного образования Башкирского государственного медицинского университета.
ОСНОВНЫЕ ПОЛОЖЕНИЯ, ВЫНОСИМЫЕ НА ЗАЩИТУ:
1. Разработан метод оценки генерации активных форм кислорода в эякуляте и определения антиокислительной активности спермоплазмы, основанный на регистрации хемилюминееценции.
2. Усиление генерации активных форм кислорода в сперме выявлено при некоторых формах мужского бесплодия,
3. При исследовании свободно-радикального окисления в эякуляте выделена разновидность «патоспермии» при идиопатическом бесплодии, определить которую стандартными методами исследования эякулята не представляется возможным.
4. Выявление патогенетических механизмов, связанных с нарушением генерации активных форм кислорода в сперме и приведших к мужскому бесплодию, позволяют обосновать соответствующую тактику лечения, направленную на нормализацию свободно-радикального окисления в эякуляте.
ОБЪЁМ И СТРУКТУРА ДИССЕРТАЦИИ Работа изложена на 116 страницах машинописного текста, состоит да разделов: «Введение», «Обзор литературы», «Материалы и методы исследования», «Результаты собственных исследований», «Обсуждение полученных результатов», «Выводы», «Практические рекомендации», «Указатель литературы». Диссертация иллюстрирована 19 таблицами, 13 рисунками. В библиографический указатель включено 205 источников литературы, из которых 88 - отечественные и 117 - зарубежные.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В данной работе, в соответствии с поставленной целью и задачами, были выделены следующие основные этапы исследования (таблица 1). Было предварительно обследовано 160 мужчин, обратившихся в Республиканский Центр планирования семьи и репродукции с медико-генетической консультацией на базе Республиканской клинической больницы им. Г.Г.Куватова. Из них 10 человек - это мужчины с доказанной фертильностью (доноры спермы). Остальные 150 мужчин обратились по поводу бесплодия в браке. Из этого числа обследованных были исключены пациенты с азооспермией, генетическими аномалиями, острыми воспалительными процессами специфической и неспецифической этиологии (орхоэпидидимиты, простатиты, везикулиты, уретриты), с доказанными иммунологическими
факторами инфертильности, а также мужчины старше 40 лет. В группу наблюдения не вошли также мужчины, фертильность супруг которых была сомнительной (трубное бесплодие, нарушения менструального цикла, эндометриоз, лоликистоз яичников и т.д.).
В результате направленного отбора выделена группа соматически здоровых сексуально активных мужчин (41 пациент), которая явилась объектом углубленного клинико-лабораторного обследования. в настоящей работе. Основную группу составил 31 пациент с мужским фактором бесплодия, контрольную группу составили 10 пациентов с доказанной фертильностью (доноров спермы).
Таблица 1
Общая характеристика проведенного исследования _
№ Этапы и задачи исследования Объект и объем исследования Вид исследования
1 Определение показателей нормы ХЛ семенной жидкости и ее компонентов 10 здоровых доноров Исследование яюминолзависимой (ЛЗХЛ) и Ре2" индуцированной ХЛ семенной жидкости и ее компонентов.
2 Клинико-лабораторное обследование бесплодных мужчин, исследование ХЛ семенной жидкости и ее компонентов. 31 пациент, состоящий в бесплодном браке; 10 здоровых доноров Объективное обследование; общеклиническое, стандартный лабораторный анализ семенной жидкости. Регистрация люминолзависимой (ЛЗХЛ), Ге2+индуцированной ХЛ семенной жидкости, клеток и спермоплазмы.
3 Анализ результатов сравнения, выбор наиболее информативных показателей для оценки фертильносги 31 пациент, состоящий в бесплодном браке; 10 здоровых доноров Статистическая обработка данных с использованием 1-критерия Стьюдента, сравнение показателей ХЛ семенной жидкости с традиционными клинико-лабораторными данными.
Было проведено определение показателей нормы ХЛ семенной жидкости и её компонентов путем обследования мужчин контрольной группы. Далее выполнено клинико-лабораторное обследование, исследование ХЛ спермы и её компонентов мужчин основной группы. После статистической обработки полученных результатов, анализа полученных данных проведен
выбор наиболее информативных показателей, характеризующих функциональное состояние спермы.
Всем" пациентам проведено комплексное клинико-лабораторное обследование с применением инфекционного скрининга (путем полимеразной цепной реакции), гормональных методов диагностики (определение фолликулостимулирующего гормона, тестостерона, пролактина), трансректального ультразвукового исследования предстательной железы и семенных пузырьков, доплерографии сосудов мошонки. Проводилось исследование сока предстательной железы. Донорам спермы и пациентам с олигозооспермией выполнено кариотипирование с целью исключения генетической патологии. Всем пациентам проводились общеклинические исследования эякулята, включающие двукратную оценку семенной жидкости, полученную с интервалом 14 дней. В обеих группах регистрировали ЛЗХЛ и Fe2 "-индуцированную ХЛ цельной спермы и её компонентов. Разделение клеток семенной жидкости проводили методом изопикнотического центрифугирования в градиенте плотности,
Регистрацию люминолзависимой хемнлюминесценции (ЛЗХЛ) и Fe2*-индуцированной ХЛ эякулята проводили на аппарате «Хемилюминомер - 003» с компьютерным обеспечением, изготовлешшм в Межвузовской лаборатории технических систем медико-биологических исследований. Об интенсивности ЛЗХЛ судили по ряду параметров, в первую очередь, по светосумме (СС) и максимальной амплитуде свечения (МсС), которые соответствовали скорости образования АФК. Перед измерением свечения определенный исследуемый объем спермы смешивали с 2 мл физиологического раствора, содержащего люашмол (5-амино-2,3-дигидро-1,4-фталазинднон) в конечной концентрации 105 М, и помещали в светоизолированную камеру прибора. Тщательно перемешивали и вели запись ХЛ при 37 °С в течение 5 мин.
Для оценки антиокислительной активности 0,1 мл спермоплазмы добавляли к модельной системе (МС). В качестве модельной системы использовали 20 мл фосфатного буфера (КН2РО4- 20 rtiM, КС1 - 105 шМ, рН доводили до 7,45 титрованием насыщенным раствором КОН) с цитратом (50 гпМ) и люминолом (10"? М). В течение 10 секунд записывали темповой ток, после чего вносили инициатор образования АФК - 1 мл 50 шМ раствора сернокислого железа (FeS0471120). Конечная концентрация FeS04 в среде инкубации составляла 2,5 тМ, Запись свечения проводили в течение 5 минут при постоянном перемешивании. При оценке Ре2+-индуцированной ХЛ определяли величину спонтанного свечения (СпС), продолжительности латентного периода от момента введения ионов железа до начала развития медленной вспышки. Также оценивали амплитуды быстрой и медленной вспышек.
С целью определения источника АФК в эякуляте проводили разделение клеток спермы в градиенте плотности путем изопикнотического центрифугирования в градиенте плотности. В качестве градиента использовали фиколл/гипак: 20мл 9% фиколла ■+■ 10,0 мл 50% гипака; плотность 1,12 г/мл. рН
приготовленного градиента доводилась до 7.5. Раствор фиколла обладает незначительным осмотическим давлением во избежании повреждения разделяемых клеток. Для разделения клеток 1мл эякулята наслаивали на 1мл приготовленного градиента и центрифугировали при 500 g в течение 20 минут. Убирали надосадок, оставляя 0,2 мл центрифугата, который встряхивали и измеряли концентрацию сперматозоидов. Также проводили окраску полученных мазков с целью определения полиморфноядерных лейкоцитов. Для исследования концентрацию сперматозоидов доводили до исходной величины, то есть до уровня концентрации в нативном эякуляте, путем разведения известного объема осадка физиологическим раствором. В последующем вели регистрацию ЛЗХЛ. При использовании данной методики нейтрофилы оседали с частотой 94-95%.
Статистическая обработка полученных данных проводилась по группам мужчин методами, принятыми стандартной статистикой с использованием ПЭВМ Pentium II-200. В каждой клинической группе для оценки определенных показателей составляли вариационные ряды с последующей их обработкой: расчетом показателей структуры (в %), определением средней арифметической (М), квадратического отклонения (б), ошибки репрезентативности средней или относительной величины (т). Оценка достоверности результатов проводилась с применением критерия Стьюдента (t).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Средний возраст мужчин с доказанной фертильностью (контрольная группа) составил 28,7±0,8 лет, мужчин, обследованных по поводу бесплодия (основная группа) - 29,3±0,7 лет.
Мужчины основной группы состояли в бесплодном браке от 1 года до 13 лет (45,2% обследованных свыше 2,5 лет), В анамнезе у них наиболее часто встречались хронический простатит, заболевания, передающиеся половым путем, варикозное расширение вен семенного канатика. 10 (32,3%) мужчин имели факторы производственной вредности.
Мужчины контрольной группы не имели в анамнезе вышеперечисленных заболеваний, состояли в браке, имели здоровое потомство (1-3 ребенка). Сперма этих мужчин использовалась для донорской инсеминации.
Показатели спермограмм мужчин контрольной группы соответствовали нормативным требованиям.
По результатам анализа спермограмм у мужчин с бесплодием нами в основной группе были выделены следующие подгруппы:
Нормозооспермия - (показатели соответствуют нормативным значениям) - 17 человек (54,8%);
Олигозооспермия - (снижение концентрации сперматозоидов ниже 20 млн/мл) - В человек (25,8%);
Астенозооспермия - (снижение подвижности сперматозоидов категории А-В менее 50%) - 6 человек (19,4%);
Тератозооспермия - (увеличение доли патологических форм
сперматозоидов более 40%) - определялась у 5 (16,1%) человек. Изолированно тератозооспермия не выявлялась, а сочеталась с олигозооспермией в двух случаях (6,5%) и астенозооспермией в трех случаях (9,7%).
Эти данные представлены графически на рисунках 1 и 2.
Рис. 1 Структура результатов спермограммы пациентов основной
В нормозооспермия
Ш астенозооспермия
тератозооспермия 16.1%
□ астенозооспермия
□ олигозооспермия
Рис. 2 Структура патоспермии в основной группе
Сравнительные характеристики эякулята основной и контрольной групп представлены в таблице 2. Выявлено достоверное отличие по содержанию клеток сперматогенеза в обследуемых группах: 4,7±0,7 млн/мл в
основной группе и 2±0,6 млн/мл в контрольной группе. Также выявлены достоверное уменьшение числа сперматозоидов категории «А» и увеличение числа сперматозоидов категории «О» в основной группе, по сравнению с контрольной. В обеих группах число лейкоцитов не превышало 1х 106/ мл. Достоверных отличий по содержанию лейкоцитов в анализируемых группах не выявлено.
Таблица 2
Показатели спермограммы в основной и контрольной группах
Показатели спермограммы основная группа (п-31) контрольная группа (п-1Р)
Концентрация сперматозоидов, млн/мл 54,9±8,1 81,2+11,2
Подвижность сперматозоидов, %: категории «А» 43,4±2,8*** 57,6±2,0
Морфологически полноценные, формы % 67,1+1,7 71,2+1,3
Объем, мл 3,3±0,2 3,1±0,2
Клетки сперматогенеза, млн/мл 4,7±0,7** 2+0,6
Примечание: ** -р<0,03; ***- р<0,001.
Для разработки оптимальной тактики ХЛ исследования семенной жидкости было валено выяснить, как влияют на показатели свечения изменение объема и длительность хранения исследуемого материала. Значимым моментом исследования является определение основного источника АФК в эякуляте. С этой целью на первом этапе проводили разделение эякулята на спермоплазму и клетки, в дальнейшем для отделения полиморфноядерных лейкоцитов Осуществляли изопикнотическое центрифугирование в градиенте плотности. Отдельно проводилась оценка суммарной аитиокислительной активности (АО А) спермонлазмы, степень которой оценивалась по способности подавлять свечение модельной системы.
Влияние изменения объема и длительности хранения эякулята на уровень ЛЗХЛ.
С целью выработки нормативных показателей ЛЗХЛ семенной жидкости были обследованы пациенты контрольной группы. Для регистрации ЛЗХЛ исследуемый материал забирался в следующих объемах: 0,05; 0,1 и 0,3 мл. По мере увеличения объема исследуемого материала шел рост основных параметров ХЛ. Ввиду невозможности получения большого количества материала и необходимости его использования для других анализов решено
ограничиться объемом исследуемого образца равным 0,1мл. С целью исключения изменений ЛЗХЛ в процессе хранения проведена оценка ХЛ в контрольной группе. Запись ЛЗХЛ вели через 15; 30; 45; 60 мин. Характер ХЛ спермы не меняется в течение 60 минут. Следовательно, в течение часа от момента сбора эякулята, при соблюдении правил сбора, транспортировки, хранения можно проводить измерение ХЛ эякулята.
Определение источника АФК в эякуляте.
Возможными источниками АФК в эякуляте могут являться сперматозоиды и круглые клетки. В качестве материала для исследования использовали 0,1мл взвеси клеток и 0,1 мл спермоплазмы, полученные после центрифугирования 1 мл эякулята при 500g в течение 20 минут. Каждый образец помещали в физиологический раствор люминола в конечной концентрации 10"5 М, вели запись по разработанному протоколу. Полученные данные представлены в таблице 3. На основе полученных данных можно сделать вывод, что источником АФК в эякуляте являются клетки. Уровень показателей светосуммы и максимальной светимости достоверно отличаются от соответствующих показателей полученных при исследовании спермоплазмы.
Таблица 3
Уровень ЛЗХЛ клеток и спермоплазмы в контрольной группе........... >=10)........
Показатели ЛЗХЛ Диапазон значений Среднее значение М±т Уровень достоверности отличий
клетки плазма клетки плазма
светосумма, отн.ед. 4.2918.75 0.351,73 8.6±2.8 0.9±03 р< 0,05
спонтанная светимость, отн.ед. 0.172.11 0.062.62 1.0*0.5 0.5±0.5 -
максимальная светимость, отн.ед. 1.125.41 0.160.57 2.4±0.8 0.4±0.1 р< 0,05
Для определения уровня генерации АФК различными клетками семенной жидкости 1 мл эякулята подвергали изопикнотическому центрифугированию в градиенте плотности. При использовании данной методики нейтрофилы оседали с частотой 94-95%. Результаты исследования эякулята в контрольной группе представлены в таблице 4.
Таблица 4
Уровень ЛЗХЛ нативной спермы и отмытых сперматозоидов в контрольной группе (п~10)
Показатели ЛЗХЛ Нативная сперма Отмытые сперматозоиды Уровень достоверности отличий
светосумма, отн.ед. 2,9±0,8 2,8±0,4
спонтанная светимость, отн.ед. 0,9±0,27 1Л±0,07 -
максимальная светимость, отн.ед. 0,7+0,17 0,6±0,1 -
Таким образом, можно сделать вывод о том, что примесь лейкоцитов в эякуляте здоровых доноров достоверно не влияет на суммарный уровень ХЛ семенной жидкости.
Для определения роли лейкоцитов в генерации АФК проведено обследование 5 пациентов с лейкоспермией, которые не вошли ни в основную, ни в контрольную группы. Уровень лейкоцитов у этих мужчин превышал 1x106, и составил в среднем 2,5±0,ЗхЮ"5. Обследование проводилось по вышеуказанной методике. Полученные результаты представлены в таблице 5.
Таблица 5
Уровень ЛЗХЛ нативной спермы и отмытых сперматозоидов у ___пациентов с лейкоспермией _________
Показатели ЛЗХЛ Лейкоспермия Нативная сперма в контр, группе
Нативная сперма Отмытые сперматозоиды
светосумма, отн.ед. 30,2±6,5* 4,4±1,2 2,9±0,8
спонтанная светимость, отн.ед. 7,1±1>3* 1,23±0,7 0,9±0,3
максимальная светимость, отн.ед. 9,3±2,1* 2,6±0,8** 0,7±0,2
Примечание: * - р<0,05 в сравнении с отмытыми сперматозоидами;
**- р<0,05 в сравнении с контрольной группой. Получены
достоверные различия по всем показателям ЛЗХЛ после выделения отмытых сперматозоидов у пациентов с лейкоспермией. Сравнивая уровни показателей ЛЗХЛ нативной спермы в контрольной группе и уровни показателей ЛЗХЛ отмытых сперматозоидов у пациентов с лейкоспермией, достоверные различия получили по уровню МсС. Уровни СС и СпС достоверно не различались. Так как источником АФК в эякуляте являются сперматозоиды и лейкоциты, то в случаях лейкоспермии у пациентов методика ЛЗХЛ спер мы может быть выполнена после разделения клеток методом изопикнотического центрифугирования в градиенте плотности.
Определение антиокислительной активности спермоплазмы.
Интегральной величиной антиоксидантного потенциала семенной
плазмы является способность спермоплазмы угнетать свечение модельной системы, в которой протекают реакции СРО.
Антиокислительные свойства спермоплазмы оценивали в % от величины угнетения свечения МС, при добавлении к последней 0,1мл спермоплазмы. Расчет проводили по формуле:
SAOA= 100% - (SMC - SMCCIT)/ SMCrl00%, где SAOA - суммарная антиокислигельная активность; SMC - светосумма модельной системы; SMCCI1 - светосумма модельной системы + спермоплазма. Суммарная АО А спермоплазмы доноров составила в среднем 41,9 %. Суммарная АОА спермоплазмы пациентов основной группы составила в среднем 41,6%.
На рисунке 3 представлен алгоритм проведения экспресс-метода регистрации ХЛ эякулята.
Рис. 3. Алгоритм определения АФК и АОА эякулята.
Изучение процессов генерации АФК спермы в норме было выполнено у 10 пациентов контрольной группы (здоровых доноров спермы). В дальнейших исследованиях использовались полученные результаты в качестве нормативов для сравнения с показателями ЛЗХЛ и Ре2 индуцированной ХЛ мужчин, состоящих в бесплодном браке. Изучение процессов генерации АФК спермы при патологии было выполнено у 31 пациента основной группы (мужчин с бесплодием).
В таблице 6 представлены основные показатели ЛЗХЛ в основной и контрольной группах до и после разделения клеток. Выявлены достоверные различия между уровнями ХЛ основной и контрольной групп. Повышение параметров СС в основной группе, вероятно, связано с различной способностью лейкоцитов генерировать АФК, а также с патоспермией, выявляемой у пациентов основной группы. Для исключения роли лейкоцитов в генерации АФК проведен сравнительный анализ после разделения клеток в градиенте плотности. В результате показатели ЛЗХЛ в основной группе после отмывания оказались значительно ниже, чем в нативной сперме, но достоверность различий с контрольной группой сохранялась.
Таблица 6
Основные показатели ЛЗХЛ в наблюдаемых группах
Основные показатели ЛЗХЛ Основная группа (п-31) Контрольная группа (п*10)
напшная г сперма 1 Сяетосумма свечения,отн.ед 28,9±8,5** 2.9±0,8
Спонтанное свечение,отаед 4,8±1,5* 0,9А0,3
Максимальная светимость,отн.ед 6,7±1,9** 0,7±0,2
отмытые сперматозоид Свстосумма свечения,отн.ед 12,1±1,9*** 2,8±0,4
Спонтанное свечение,отн.ед 2,5±0,5** 1,1±0Д
Максимальная светимость,отн.ед 4,1±0,8*** 0,6±0,)
Примечание: *- р<0,05; ** - р<0,01; *** - р<0,001.
На следующем этапе исследования сопоставляли морфо-функциональные параметры эякулята пациентов основной группы со способностью к генерации АФК сперматозоидами. В таблице 7 представлены сводные данные по всем подгруппам основной группы до и после разделения клеток, а также аналогичные данные обследования контрольной группы.
Морфо-функцноналъные показатели и показатели ХЛ основной и контрольной групп
Таблица 7
Тератоэоспермия (п-5) Нормозооспермия (п=17) Одигозооспермия (п=8) Астаюзоспермда (п=6) Основная группа (0=31) контрольная группа <п=10)
отмыт, клетки натив. сперма отмыт, клетки iMTHB. сперма отмыт, клепаг натив. сперма ОТМЫТ. клетки наша, сперма ошьгг. клетки натии. сперма ОТМЫТ. клегги натив. сперма
Кол-во- клеток млн/мл - 27,6±6,5 - 71,4+ 13,5 - П.Ш.8 - 50,5+7,1* - 54,9± 8,1 - 81,2±IU
а - 2S,4±4,4 **+ - 54,6+2,2 - 41,9±4,5 - 21,3±4,6 - 43,4± 2,8*** - 57,612,0
1 Ь - 19+5,7 - 14,8±1,б 16,1+2,8 - 14+1,4 - 15±1,1 - I2,t±2,4
"s с - 7Д±3,1 4,8±1,1 - 7,3£2,9 16,714,9* - 6,9±1,6 3,Ш,6
D - 48,4±7,8* - 25,8±2.1 - 34,7±1,6 - 4816,6** - 34,71 1,9** - 27,2+1,3
Морфология % - 47,4±1,8 - 73,1 ±0,9 - 62,9±4,2 - 60,2±5,4 - 67,111, 7 - 71,211,3
Кол-во лейкоцитов 0 менее Ылв"мд 0 менее 1мяа"мл 0 менее 1 млн/мл 0 менее 1 млнмл 0 менее 1млн/м 0 менее 1мли"юг
а о СС 23,3± 3,90"** 39,3+11,3 12,9± 2,8** 38,3± 14,9* 8,2±3,2 13,4 ±6,8 15.3+ 53* 22,9±Ш,9 12,1+ 1 д*** 28,9± 8,5** 2,8±0,4 2,9+0,8
§ 3 2 s СпС 3,03±0.6 3,910,7** 3,3±0,8 ** 7,1±2,7* 1,4+0,4 1.Ш.7 1,810,7 2,110,7 2,510,5 4,8+1,5 * 1,1+0,1 0,910,3
Ы s MC 8,242,6* 9,9+3,1** 4,5+1,2 »* 8,7±3,4* 2,6+1,3 3,4±1,9 5,02± 2,5 5,612,8 4,110,8 6,7+1,9 ** 0,6±0,1 0,7±0,2
S а СС - 29,3±1.8 - ЗЗ.Ш.0 - 30,1 ±3,2 - 32,Э±2,1 - 31,7± 1,1 - Э1,9±1,9
т Ш СпС - 7,4+1,3 - 7,5+1,9 - 8,9±!,6 - 8,0±},8 - 8,8±] - б,9±1,2
Ьз Я £ а а.? Мс - 13,9±0,9 - 15ДЮ.8 - 14,8+0,6 - 15,6+0,7 14,8± 0,3 - 15,Ш,0
Из таблицы видно, что в целом морфо-функциональные параметры эякулята основной группы достоверно отличались от контрольной лишь по подвижности: по категории «А» (быстрое поступательное движение сперматозоидов) - р<0,001, и по категории «В» (неподвижные сперматозоиды) - р<0,01. Различия при анализе морфо-функциональных характеристик в подгруппах соответствовали принципу, по которому было проведено разделение на данные подгруппы. Так, в подгруппе с олигозооспермией достоверные различия по сравнению с контрольной группой были выявлены по количеству клеток (р<0,001) и по подвижности (по категориям «А» и «О» - р<0,01), при этом концентрация сперматозоидов была ниже нормативных показателей ВОЗ, а процент подвижных сперматозоидов соответствовал нормам ВОЗ. В подгруппе с астенозооспермией достоверные различия по сравнению с контрольной группой были выявлены по уровню подвижности (категории «А» - р<0,001, категории «С» - р<0,05, категории «О» - р<0,01) и по количеству клеток - р<0,05, хотя в среднем концентрация сперматозоидов в этой подгруппе соответствовала нормам ВОЗ, В подгруппе с нормозооспермией достоверных различий по сравнению с контрольной группой не было.
В подгруппе с тератозооспермней достоверные различия выявлены, в отличие от остальных подгрупп, по морфологическим параметрам (р<0,001), а также по показателям прогрессивно подвижных сперматозоидов (р<0,001), концентрации половых клеток (р<0,01).
При анализе показателей ЛЗХЛ нативной спермы пациентов основной группы выявлены достоверные отличия по уровню СС (р<0,01), СпС (р<0,05), Мс (р<0,01) в сравнении с контрольной группой. Различия сохранились и после разделения клеток в градиенте плотности; СС (р<0,003), СпС (р<0,01), Мс (р<0,001). Однако, не во всех подгруппах основной группы были получены аналогичные результаты, достоверные различия выявлены при нормозооспермии и тератозооспермии. Основные показатели ЛЗХЛ при тератозооспермии достоверно отличались от соответствующих показателей контрольной группы (СС - р<0,01, СпС - р<0,01, Мс - р<0,01). Различия сохранились и после разделения клеток в градиенте плотности: СС (р<0,001), СпС (р<0,01), Мс (р<0,05). Видимо, увеличение показателей ЛЗХЛ обусловлено большей способностью сперматозоидов с измененной морфологией к генерации АФК.
При исследовании нативной спермы пациентов с олигозооспермией и астенозооспермией по сравнению с контрольной группой достоверных различий не выявлено. В то же время после разделения клеток показатели СС в подгруппе с астенозооспермией стали достоверно отличаться от контрольной группы (р<0,05). На увеличение среднего показателя светосуммы повлияло наличие в данной подгруппе пациентов с тератозооспермией. Как уже было указано выше, изолированно тератозооспермия не выявлялась, а сочеталась с олигозооспермией в 6,5% случаев и астенозооспермией в 9,7%случаев.
При сравнении показателей ЛЗХЛ у пациентов основной группы с нормозооспермией и пациентов контрольной группы были получены достоверные различия по уровню СС (р<0,05), СпС (р<0,05), Мс (р<0,05). Различия увеличились после разделения клеток в градиенте плотности: СС (р<0,01), СпС (р<0,01), Мс (р<0,01). Таким образом, у пациентов основной группы с нормозооспермией не было выявлено достоверных отличий с контрольной группой по основным морфо-функциональным характеристикам эякулята, но обнаружены достоверные отличия по показателям ЛЗХЛ.
На основании этого можно сделать вывод, что имеется разновидность «патоепермии» при бесплодии, установить которую стандартными методами исследования эякулята не представляется возможным. При проведении анализа была выявлена большая способность к генерации АФК сперматозоидов с неполноценной морфологической структурой, что изолированно не определялось, а сочеталось с другими видами патоепермии. Это является доказательством того, что АФК на этапе созревания половых клеток могут служить непосредственной причиной патоепермии. Этап дозревания сперматозоидов проходит на уровне придатка яичка. Наибольшее число пациентов с патоспермией имели различные нарушения на уровне эпидидимиса с одной или двух сторон, следовательно, действие патологических факторов именно на уровне придатка яичка приводит к формированию патологических форм сперматозоидов, которые в последующем оказывают повреждающее действие на более полноценные формы. Это проявляется в виде увеличения содержания неподвижных форм сперматозоидов в эякулятах с высоким уровнем СРО.
В исследовании показана способность спермоплазмы угнетать свечение модельной системы. Данный феномен ингибирующего влияния биологической жидкости на генерацию АФК можно объяснить наличием в ней антиоксидантов, угнетающих образование радикалов на различных фазах цепной реакции СРО. Спермоплазма пациентов основной и контрольной групп в одинаковой степени влияла на показатели СС и Мс модельной системы. Таким образом, нарушение процессов свободно-радикального окисления в эякуляте связано с повышенной генерацией АФК клетками (морфологически и функционально аномальные сперматозоиды и лейкоциты), при этом суммарная антиокислительная активность остается стабильной в отсутствии поражения добавочных половых желез.
Изучение фракций семенной жидкости в процессах СРО, выявление их участия в ХЛ представляло интерес для уточнения причин, ведущих к нарушению состояния СРО при некоторых нозологиях, оцененных по нормативам ВОЗ. Обнаружено увеличение основных показателей ЛЗХЛ как осадка, так и цельного эякулята у инфертильных мужчин по сравнению с контрольной группой. Не выявлено достоверных различий при исследовании суммарной АОА семенной плазмы в указанных группах. По данным литературы, процент объемных компонентов эякулята, образующийся в яичках, составляет в среднем 5%. Основная масса эякулята формируется на
уровне добавочных половых желез (предстательная железа, семенные пузырьки, Куперовы железы) и представлена в основном жидкой частью эякулята (спермоплазма). Спермоплазма формирует основную массу АО потенциала семенной жидкости. Можно предположить, что АОА спермоплазмы не влияет на формирование половых клеток, так как образование основного объема спермоплазмы происходит на уровне добавочных половых желез. Незрелые сперматозоиды с повышенной способностью к генерации АФК могут оказывать свое повреждающее действие на полноценные половые клетки до того момента, как последние смешаются с основным объемом спермоплазмы, являющейся основным источником антиоксидантов в эякуляте. Учитывая то, что различий между основной и контрольной группой по уровню суммарной АОА не было выявлено, а уровень определяемых показателей хемилюминесценцин (СС, СпС, Мс) достоверно различался, можно заключить, что АФК играют роль в патогенезе мужского бесплодия и применение антиоксидантных препаратов клинически оправдано. С целью дифференцированного подхода к антиоксидантной терапии мужского бесплодия целесообразно предварительно определять состояние свободно-радикального статуса. При наличии дисбаланса процессов окисления необходимо проводить коррекцию генерации АФК в зависимости от локализации поражения, действуя либо на уровне придатков яичек, либо на уровне добавочных половых желез.
Таким образом, на основе обобщения данных литературы и результатов собственных исследований можно прийти к выводу, что АФК играют важную роль в патогенезе мужского бесплодия. Разработан эффективный экспресс-метод определения АФК в сперме, основанный на регистрации ХЛ. Проведена оценка уровня антиокислительной активности в спермоплазме. Клинически обоснована эффективность применения хемилюминесцентных методов исследования как дополнительного критерия оценки мужского фертильности. Намечены патогенетические механизмы к лечению некоторых видов мужского бесплодия антиоксидантами.
1. Разработан и апробирован в клинических условиях комплексный подход для выявления мужской инфертильности, основанный на оценке состояния свободно-радикального окисления в эякуляте путем определения генерации активных форм кислорода в сперме и антиокислительной активности в спермоплазме.
2. Выбраны оптимальные условия для измерения активных форм кислорода методом регистрации люминолзависимой хемилюминесценции эякулята и определения антиокислительной активности спермоплазмы в модельной системе, генерирующей активные формы кислорода,
3. В норме сперматозоиды характеризуются низкой способностью к генерации активных форм кислорода, а спермоплазма обладает высокой антиокислительной активностью.
4. При патологии (мужской инфертильности) происходит увеличение интенсивности свободно-радикального окисления в эякуляте за счет повышенной генерации активных форм кислорода функционально неполноценными сперматозоидами на фоне неизмененной антиокислительной активности спермоплазмы при отсутствии воспаления в урогенитальной зоне.
5. Метод регистрации спонтанного люминолзависимого свечения эякулята и определения общей антиокислительной активности спермоплазмы является эффективным дополнительным критерием при оценке мужской инфертильности, наряду с традиционными клинико-лабораторными методами исследования.
1. Разработанный комплексный метод хемилюминесцентного исследования процессов генерации активных форм кислорода в эякуляте и определения общей антиокислительной активности спермоплазмы рекомендуется применять для оценки мужской инфертильности в клинической урологии, как эффективный дополнительный метод диагностики.
Перед измерением свечения 0,1 мл исследуемой спермы следует смешать с 2 мл физиологического раствора, содержащего люмииол (5-амино-2,3-дигидро-1,4-фталазиндион) в конечной концентрации 10-5 М, тщательно перемешать и вести запись хемилюминесценцин при 37 °С в течение 5 мин;
Исследование может быть проведено в течение 1 часа после разжижения;
При величине светосуммы, превышающей 2,9±0.8 спн.ед., даже при нормативном" содержании лейкоцитов, необходимо проведение разделения клеток путем изопикнотического центрифугирования в градиенте плотности с
последующим определением уровня люминолзависимой
хемилюминесценции;
В качестве градиента плотности используется фиколл/гипак: 20мл 9% фиколла + 10,0 мл 50% гипака; плотность 1,12 г/мл. рН приготовленного градиента доводится до 7.5. Для разделения клеток 1мл эякулята наслаивается на 1мл приготовленного градиента и центрифугируется при 500 g в течение 20 минут.
В качестве модельной системы используется 20 мл фосфатного буфера (КН2Р04 - 20 mM, КС1 - 105 тМ) с цитратом (50 тМ) и люминолом (10-5 М). В течение 10 секунд длится запись темнового тока, после чего вносится инициатор XJI - 1 мл 50 шМ раствора сернокислого железа (FeS047H20). Запись свечения проводится в течение 5 минут;
Спермоплазму, полученную после центрифугирования семенной жидкости, в объеме 0,1 мл следует добавить к модельной системе. В течение 10 секунд длится запись темнового тока, после чего вносится инициатор XJI -1 мл 50 шМ раствора сернокислого железа. Конечная концентрат« сернокислого железа в среде инкубации составляет 2,5 тМ, Запись свечения проводится в течение 5 минут при постоянном перемешивании;
Антиокислительные свойства спермоплазмы оцениваются в процентах от величины угнетения свечения МС, при добавлении к последней спермоплазмы по формуле:
S АОА= 100% - (SMC - SMCCn)/ SMC г 100%,
где SAOA - суммарная антиокислительная активность;
SMC - светосумма модельной системы;
SMCCn - светосумма модельной системы + спермоплазма.
4. Применение антиоксидантных препаратов при терапии мужской инфертильности целесообразно при повышении генерации активных форм кислорода в эякуляте, сопровождающемся увеличением интенсивности люминолзависимой хемилюминесценции сперматозоидов, или уменьшении суммарной антиокислительной активности спермоплазмы, оценивающейся по угнетению свечения модельной системы.
1. Методы оценки репродуктивной функции мужчин. - Уфа: Здравоохранение Башкортостана, 2001. - 48с. (соавт.: Р.Р.Фархутдинов, Ш.Н.Галимов, Ф.Х.Камилов, Э.Ф.Аглетдинов, Х.Г.Валеева, А.П.Голощапова, Н.Й.Симонова,
B.И.Иваха)
2. Метод регистрации хемилюминесценции для оценки мужской фертильности// Новые медицинские технологии: Материалы 1-го Международного конгресса. - СПб., 2001. - С.62. (соавт.: Р.Р.Фархутдинов, Р.Р.Садыков)
3. Репродуктивное здоровье мужчин как индикатор экологического неблагополучия"/ Лечение бесплодия: нерешенные проблемы: Сборню научных трудов. - Саратов, 2001. - С.15-16, (соавт.: Ш.Н.Галимов Ф.Х.Камилов, Э.Ф.Аглетдинов, Х.Г.Валеева, В.И.Иваха)
4. Влияние активных форм кислорода на мужскую фертильность.// Вопрось теоретической и практической медицины: Материалы 66-й Республиканец научной конференции студентов и молодых ученых БГМУ. - Уфа, 2001, -
5. Свободнорадикальное окисление в патогенезе мужского бесплодия/. Свободные радикалы, антиоксиданты и болезни человека: Материалы научно практической конференции с международным участием. - Смоленск, 2001. -С.176-177. (соавт.: Р.Р.Фархутдинов, Р.Р.Садыков)
6. Активные формы кислорода в эякуляте// Здравоохранение Башкортостана -2001. - Спец. выпуск Х»5.: Неотложные состояния в урологии. - С.92. (соавт. Р.Р.Садыков Р.Р.Фархутдинов, М..А. Нартайлаков)
7. Оценка репродуктивного здоровья мужчин-рабочих одного из предприятий г Туймазы// Здравоохранение Башкортостана. - 2001. - Спец. выпуск №8. ■ С.28-32. (соавт.: А.В,Варшавский, Э.Ф.Аглетдинов, М.И.Павлов, А.А.Ракчаев
8. Оценка риска репродуктивному здоровью мужчин в Республик Башкортостан// Проблемы интеграции науки, образования и производств южного региона Республики Башкортостан: Сборник научных трудов Peer научно-практической конф. - Уфа: Кзд-во «Тилем», 2001. - С. 13-16. (соавт. Ш.Н.Галимов, Ф.Х.Камилов, Э Ф.Аглетдинов, Х.Г.Валеева, А.П Голощапош И.И.Симонова, А.Р.Мавзютов, В.И.Иваха)
9. Антропогенное загрязнение среды обитания и репродуктивное здоровь мужчины// Химическая экология: Материалы школы-семинара. - Уфа, 2001. С. 163-166. (соавт.: Ш.Н.Галимов, Ф.Х.Камилов, Э.Ф.Аглетдинов)
10. Анализ риска репродуктивному здоровью мужчин в экологическ неблагополучном регионе: критерии оценки.//Научные аспект] экологических проблем России: Тез. докл. Всероссийской конф. - СПб., 200 -С. 140. (соавт/. Ш.Н.Галимов, Ф.Х.Камилов, Э.Ф.Аглетдинов,Н.И.Симонов; Х.Г.Валеева,. П.Голощапов, В.И.Иваха)
11, Синдром андрогенной недостаточности как маркер техногенног загрязнения среды обитання//Проблемы репродукции, - 2002. -Т.8, №1, С.46-50. (соавт.: Ш.Н.Галимов, Ф.Х.Камилов, Э.Ф.Аглетдинов, Х.Г.Валеев А,П.Голощапов, В.И.Иваха).
18.09.2014
Мужское бесплодие и окислительный стресс: роль диеты, образа жизни и пищевых добавок.
Стивен А Броуди, доктор медицины, доктор философии; директор Института передовых репродуктивных технологий; бывший клинический доцент, медицинский факультет Калифорнийского университета в Сан-Диего, Сан-Диего, Калифорния.
Абстракт
Почти каждая пятая пара страдает бесплодием или субфертильностью. По всему миру в анализах спермы наблюдается снижение численности сперматозоидов. Негативное влияние на процесс сперматогенеза могут оказывать факторы внешней среды, изменения в образе жизни и питание. У большинства пациентов мужское бесплодие и снижение числа сперматозоидов в сперме носят идиопатический характер. Общими характеристиками этих случаев, по-видимому, являются усиление окислительного стресса и нарушение метаболической функции. Они могут главным образом затрагивать незрелые сперматозоиды и лейкоциты. Высокое содержание в мембране сперматозоидов полиненасыщенных жирных кислот, связанных с фосфолипидами, делает их более чувствительными к перекисному повреждению. В результате разрыва или повреждения мембраны страдает функция сперматозоида. Этот процесс приводит к нарушению функции спермы, изменению показателей анализа спермы, фрагментации ДНК и функциональным расстройствам, влияющим на способность сперматозоидов к пенетрации и взаимодействию с ооцитом. Примечательно, что, по данным исследований, антиоксиданты и другие схожие микронутриенты способны снижать окислительный стресс, и, тем самым, улучшать функцию спермы. Оптимизированные пищевые добавки для улучшения качества спермы следует рекомендовать во всех случаях мужской субфертильности, а также бесплодия неустановленной этиологии.
Введение
В рутинной клинической практике для оценки мужской репродуктивной функции используется анализ спермы. Базовый анализ включает определение концентрации спермы, подвижности и морфологии сперматозоидов, объёма и наличия или отсутствия лейкоцитов. К сожалению, изменения в результатах анализа спермы являются лишь косвенным показателем репродуктивной функции .
Очень низкое число подвижных сперматозоидов обычно свидетельствует о снижении фертильности. Тем не менее, очевидно, что проблема заключается не только в их численности, так как даже одного сперматозоида достаточно для оплодотворения яйцеклетки, ежемесячно созревающей в организме женщины-партнёра.
Низкое число сперматозоидов и другие изменения в анализе спермы в действительности свидетельствуют о более глубоких нарушениях функции спермы. Эти нарушения включают фрагментацию ДНК, метаболические изменения, влияющие на сперматогенез, и негативное воздействие свободных радикалов .
Сперматозоиды осуществляют интенсивные движения при помощи хвоста. Из всех клеток человеческого тела они обладают самой высокой подвижностью. Продвижение сперматозоидов вперёд необходимо для преодоления ими женских половых путей. Кроме того, сперматозоиды должны обладать функциональной способностью пенетрировать ооциты. Эти процессы требуют высокого уровня окислительного метаболизма. В результате, продуцируются активные формы кислорода (АФК), одноатомные молекулы, называемые свободными радикалами. Присутствие АФК является патофизиологическим признаком окислительного стресса. Образования свободных радикалов приводит к нарушению функции спермы .
Важность снижения окислительного стресса
Низкие уровни АФК, продуцируемые внутри сперматозоидов, участвуют в регуляции приобретения спермой оплодотворяющей способности. Однако избыточное формирование свободных радикалов может приводить к повреждению сперматозоидов. При высоких уровнях АФК наблюдается снижение подвижности сперматозоидов и повреждение их ядерной ДНК. Состояние окислительного стресса возникает вследствие одной из двух причин: 1) повышенной продукции свободных радикалов или 2) недостаточной антиоксидантной активности для их нейтрализации.
Если снижения окислительного стресса не происходит, это потенциально может приводить к развитию широкого ряда нарушений, влияющих на репродуктивные процессы у мужчин. Одним из главных патофизиологических эффектов свободных радикалов является повреждение клеточной мембраны сперматозоидов путём перекисного окисления липидов.
Смысл использования антиоксидантов - предотвратить вредное влияние избыточного образования свободных радикалов на функции спермы. Применение антиоксидантов способно улучшать функции и параметры спермы, такие как численность, морфология и подвижность сперматозоидов. .
Обзор Кохрейна (Cochrane), посвящённый роли антиоксидантов в репродуктивной функции, подтверждает увеличение подвижности сперматозоидов у мужчин с субфертильностью, а также демонстрирует поразительный рост частоты наступления беременности и родов .
Было обнаружено, что, помимо антиоксидантов, другие пищевые добавки также оказывают влияние на продукцию спермы, метаболизм тестостерона, перенос энергии и подвижность клеток. Эти микронутриенты действуют совместно с антиоксидантами, улучшая функции спермы в целом и увеличивая репродуктивный потенциал . Изменение образа жизни также может способствовать снижению окислительного стресса.
Патофизиология влияния окислительного стресса на репродуктивную функцию мужчины
Окислительный метаболизм крайне важен для нормального сперматогенеза. Избыток прооксидантов может приводить к формированию свободных радикалов. Окислительный стресс возникает, если продукция свободных радикалов начинает превышать способность антиоксидантов к их нейтрализации. Приблизительно у 25% мужчин с субфертильностью в анализе спермы обнаруживается повышение уровня свободных радикалов, мерой которого служат активные формы кислорода (АФК) .
Потенциального снижения уровня активных форм кислорода и окислительного стресса можно достигнуть при помощи диеты и изменения образа жизни. Усилить антиоксидантную систему также позволяют диета и приём антиоксидантов.
Повышенная чувствительность сперматозоидов к активным формам кислорода может объясняться высоким содержанием в их мембранах жирных кислот. Окисление жирных кислот способно вызвать повреждение сперматозоидов за счёт нарушения целостности и проницаемости их мембран . Апоптоз клеток и повреждение ДНК могут возникать в сперматидах и предшественниках сперматозоидов на ранних стадиях сперматогенеза и спермиогенеза . Это может приводить к снижению в анализе спермы всех трёх показателей: численности, подвижности и морфологии.
В примордиальных половых клетках АФК способны подавлять сперматогенез и индуцировать апоптоз . В зрелых сперматозоидах АФК могут вызывать нарушение их основных функций, включая акросомальную реакцию и пенетрацию ооцита. Они также могут повреждать митохондриальную энергетическую систему клетки.
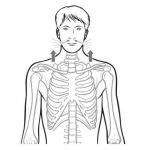
Патофизиологические эффекты окислительного стресса можно рассмотреть последовательно (рисунок):

Прооксидантный метаболизм
1) Избыток свободных радикалов и/или недостаточный антиоксидантный статус
2) Повреждение ДНК, липидов и белков примордиальных половых клеток
3) Изменение показателей анализа спермы: численности, подвижности, морфологии
4) Снижение функции спермы с нарушением акросомальной реакции и капацитации
5) Мужское бесплодие
Снижение показателя численности сперматозоидов по всему миру
Нельзя недооценивать важности изменения питания и образа жизни, а также приёма пищевых добавок для мужчин, желающих восстановить фертильность. Снижение качества и концентрации спермы в западных странах в последние несколько десятилетий носит характер эпидемии . Национальный институт экологической медицины (The National Institute of Environmental Medicine) проанализировал 62 исследования, проведённые на протяжении 52 лет до 1990 года. Было обнаружено, что в США и других западных странах показатель численности сперматозоидов в анализах спермы ежегодно снижается на 1.5 миллиона на мл. В Европе ситуация ещё более катастрофична - там снижение показателя численности сперматозоидов составляет 3 миллиона на мл в год. Эти данные были подтверждены 20-летним исследованием, окончившимся в 1995 году, и опубликованном в «New England Journal of Medicine» . Также наблюдается снижение объёма семенной жидкости.
Те же факторы, которые вызывают снижение функции спермы по всему миру, наблюдаются у мужчин с субфертильностью или бесплодием. Вот некоторые из общих причин:
Сахар и питание, вызывающее гипергликемию
Растительные масла
Транс жиры и полуфабрикаты
Ксенобиотики в продуктах питания: пестициды, гербициды и фунгициды, неферментированная соя
Ксенобиотики из окружающей среды: газы, токсины, чистящие средства, кремы
Гормоны, алкоголь и сигареты
Избыточный вес с центральным ожирением воспалительного типа
Стресс, бессонница и отсутствие физической активности
Коррекция образа жизни для улучшения репродуктивной функции у мужчин
В научной и медицинской литературе можно найти достаточно свидетельств того, что изменение образа жизни и питания способно положительно повлиять на фертильность. Вне зависимости от наличия или отсутствия изменений в анализе спермы, коррекция образа жизни может оказать огромное влияние на репродуктивный потенциал мужчины. Общий механизм, лежащий в основе этого положительного эффекта, по-видимому, заключается в снижении окислительного стресса, уменьшении воспаления и увеличении стабильности липидных мембран. Улучшение энергетического метаболизма и показателей эндогенных микронутриентов также играют определённую роль.
Стиль питания очень важен. Сбалансированная диета способна привести к снижению воспаления, образования свободных радикалов и, потенциально, генетического полиморфизма. Целью является употребление тех продуктов, которые не вызывают воспаления. Они должны иметь низкий гликемический индекс, соответствующий низким уровням инсулина. Жиры, способствующие воспалению, следует исключить . Фрукты и овощи обеспечивают нас крайне важными питательными веществами, противодействующими окислительному стрессу. Достаточное потребление воды благоприятно влияет на внутриклеточную и межклеточную среды. Кофеин следует ограничить одной чашкой кофе или двумя чашками чая в день. Зелёный чай, содержащий кофеин, может оказывать благотворное воздействие.
Физические упражнения способствуют снижению воспалительного ответа организма. Они вызывают улучшение кровотока, функции эндотелия и эластичности сосудов. Мужчина должен посвящать интервальным тренировкам хотя бы 30 минут через день, чередуя их с растяжками и силовыми нагрузками.
Курение приводит к снижению численности сперматозоидов, нарушению их подвижности и морфологии. Увеличение окислительного стресса в сперме может вызвать повреждение ДНК сперматозоидов, с её последующей фрагментацией и снижением функциональной способности .
Неумеренное употребление алкоголя распространено во многих странах мира. Общеизвестно, что избыточное потребление алкоголя нарушает функцию спермы. Этот эффект может быть пропорционален количеству потребляемого алкоголя. Если речь идёт о крепком алкоголе, допускается употребление только одной порции в день.
Сексуальную активность следует соотносить с овариальным циклом партнёрши. Есть сообщения о наступлении беременности за 5 или 6 дней до овуляции. Однако приблизительно через 16 часов после овуляции возможность оплодотворения яйцеклетки внезапно пропадает. Наиболее подходящим временем является 3 день после овуляции. С помощью простых безрецептурных наборов для прогнозирования овуляции или измерения базальной температуры можно вычислить момент выброса лютеинизирующего гормона. День этого выброса, а также один день до и после него составляют самое благоприятное для зачатия окно. Мужчине нет необходимости воздерживаться от сексуального контакта с целью увеличить численность сперматозоидов. Исследования частоты половых контактов показали, что частые сексуальные отношения не оказывают существенного влияния на фертильность. Некоторые искусственные смазки могут быть токсичны для спермы .
Вредное влияние окружающей среды часто трудно отследить и определить. К типичным вредоносным факторам относятся гербициды, фунгициды, органические газы, радиация и растворители . Способность нарушать продукцию спермы была также обнаружена у ряда лекарств . Выраженное действие оказывают тестостерон, ДГЭА и другие андрогены, включая анаболические стероиды. Хотя эти соединения увеличивают выраженность вторичных мужских половых признаков, они напрямую участвую в подавлении секреции гонадотропина. В результате этого происходит снижение сперматогенеза.
Перегревание может влиять на показатели спермы. Яички естественным образом располагаются в более прохладной среде. Такое расположение способствует продукции спермы. Следует избегать источников тепла, включая узкие сиденья велосипедов, джакузи, а также работы в зоне с высокой температурой, длительных приёмов ванны и ношения тугого или стесняющего нижнего белья .
Пищевые добавки при окислительном стрессе и нарушении функции спермы
Для улучшения функции спермы мужчины могут принимать пищевые добавки. Было обнаружено, что эти препараты положительно влияют на функцию спермы, структуру ДНК и показатели анализа спермы. Применять можно различные микронутриенты.
Существуют безрецептурные препараты, подвергающиеся лишь незначительному регулированию со стороны многочисленных органов по контролю за продуктами питания и лекарствами. Микронутриенты могут способствовать снижению воспаления, ослаблению аутоиммунных процессов, улучшению промежуточного обмена, активации ядерно-цитоплазматического транспорта и восстановлению целостности мембран сперматозоидов. Наиболее эффективным и важным классом пищевых добавок являются антиоксиданты. Это обусловлено тем, что образование свободных радикалов при окислительном стрессе играет подтверждённую роль в нарушении функции спермы.
Метаболические антиоксиданты: витамины, минералы, аминокислоты, кофакторы
Ферментные системы организма участвуют в снижении окислительного стресса. Кроме того, разнообразные витамины, минералы, аминокислоты и кофакторы оказывают на мужскую фертильность не менее значимое влияние. Научные исследования дают количественную оценку роли этих веществ в патофизиологии мужской субфертильности и мужского бесплодия. Пероральный приём пищевых добавок может играть непосредственную роль в улучшении параметров спермы, восстановлении её функции и, в действительности, увеличении частоты наступления беременности у женщин-партнёров.
«Ортомолекулярная медицина» представляет собой применение пищевых добавок с целью сохранения здоровья и преодоления болезненных процессов. Её концепция состоит в том, что болезни могут возникать из-за недостатка микронутриентов. Следовательно, приём добавок может предотвратить заболевание или, при определённых обстоятельствах, его излечить. Термин был введён Лайнусом Полингом, дважды обладателем Нобелевской премии.
Использование пищевых добавок с целью улучшения функции спермы и восстановления мужской фертильности изучалось во многих исследованиях. Некоторые из них имели ограничения в виде недостаточного числа участников, непостоянных критериев включения в исследование, неподходящей группы контроля или неопределённых результатов. Другие не были рандомизированными или проводились без плацебо-контроля, с использованием различных препаратов. Анализ Кохрейна, в котором эти ограничения были учтены, показал, что приём пищевых добавок улучшает параметры репродуктивной функции у мужчин .
Витамины играют важную роль в антиоксидантных системах организма. Витамины являются органическими соединениями; однако не все органические соединения являются витаминами. В сущности, витамины не синтезируются в количествах, достаточных для нормального функционирования организма. Например, витамин С не синтезируется в организме человека. А у большинства млекопитающих, способных его синтезировать, он не является витамином. Таким образом, особенностью витаминов является то, что их приём с пищей обязателен.
Витамин А получают из каротиноидов, обнаруживаемых в жёлтых, красных и оранжевых овощах. Каротиноиды в пищеварительном тракте превращаются в ретинал, который затем преобразуется в ретинол, основной компонент витамина. Он является антиоксидантом и участвует в регуляции роста эпителиальных клеток. Функции витамина А в мужской половой системе заключаются в стабилизации мембран сперматозоидов, участии в регуляции сперматогенеза и увеличении подвижности сперматозоидов .
Витамины группы В составляют самую обширную группу отдельных витаминов. Они выполняют роль кофакторов, участвующих в работе ферментов. Они способствуют переносу метильных, метиленовых и формильных групп в клетку. Такие витамины группы В, как фолиевая кислота, незаменимы для синтеза ДНК и, следовательно, способствуют усилению сперматогенеза и увеличению стабильности сперматозоидов, снижая фрагментацию ДНК. При низких уровнях фолиевой кислоты наблюдается снижение численности и подвижности сперматозоидов . Пиридоксин, витамин В6, оказывает синергичное действие в процессе метаболизации избыточного гомоцистеина.
Витамин С является наиболее важным водорастворимым антиоксидантом в организме человека. Как правило, высокие уровни витамина С коррелируют с улучшением подвижности сперматозоидов . Содержание витамина С в сперме, в действительности, в 10 раз превышает таковое в плазме. Он защищает ДНК сперматозоидов от повреждения свободными радикалами . Уже более десяти лет исследования демонстрируют способность витамина С увеличивать численность сперматозоидов, наряду с улучшением других параметров анализа спермы, включая подвижность и морфологию.
Витамин D является не просто витамином. Он обладает гормоноподобным действием и влияет на рост клеток, дифференцировку ткани и метаболизм минеральных веществ. Он оказывает положительный эффект на функцию мышц и укрепляет иммунную систему. Была обнаружена связь между развитием некоторых видов рака и недостаточностью витамина D. Витамин D важен для осуществления нормальных репродуктивных процессов у мужчин . Мужчины с нормальными уровнями витамина D, по результатам анализов, имели более высокую подвижность сперматозоидов, по сравнению с мужчинами, страдавшими дефицитом этого витамина .
Витамин Е является основным жирорастворимым витамином в организме человека. Учитывая, что мембрана сперматозоидов состоит из липидов, витамин Е играет ключевую роль в снижении перекисного окисления липидов под действием АФК . В некотором смысле, витамин С и витамин Е действуют в тандеме, улучшая функцию спермы. Витамин С является основным водорастворимым антиоксидантом, а витамин Е – главным жирорастворимым антиоксидантом . Исследования, проведённые у мужчин с низкими показателями оплодотворения in vitro, показали значительные улучшение после приёма добавок с витамином Е в течение 3 месяцев . Пероральный приём витамина вызывает заметное увеличение подвижности сперматозоидов за счёт снижения перекисного окисления липидов . Кроме того, имеются данные о росте общей частоты наступления беременности при приёме добавок с витамином Е .
Минералы и кофакторы
Селен является микроэлементом, способным снижать окислительный стресс. В его отсутствии процесс сперматогенеза нарушается за счёт атрофии сперматогенного эпителия. Патологические изменения сперматозоида, по-видимому, преимущественно локализуются в средней части и головке клетки. Селен необходим для созревания сперматозоидов и нормального развития яичек . Было показано, что приём добавок с селеном способствует увеличению подвижности сперматозоидов и снижению их повреждения свободными радикалами.
Цинк – ещё один микроэлемент, необходимый для формирования сперматозоидов, влияющий на их подвижность, а также метаболизм тестостерона. Он входит в состав более чем 200 ферментов, участвующих в делении клетки, синтезе белков и метаболизме нуклеиновых кислот. Его уровни в сперме коррелируют с качеством сперматозоидов . Имеются чёткие указания на способность добавок с цинком вызывать увеличение численности и подвижности сперматозоидов, а также уровней тестостерона .
Коэнзим Q10 обрёл большую популярность в неспециализированной прессе, преимущественно вследствие того наблюдения, что его показатели снижаются у пациентов, принимающих статины. Он является антиоксидантом, играющим ключевую роль в переносе энергетических субстратов и продукции энергии в клетке. В небольших количествах он содержится в некоторых продуктах питания. Максимальные уровни коэнзима обнаруживаются у человека до 20 лет, после чего начинают с возрастом снижаться. Серьёзные исследования показали, что Ко-Q10 способен улучшать все три параметра анализа спермы: концентрацию, подвижность и морфологию . В некоторых случаях для увеличения подвижности сперматозоидов требуется не менее шести месяцев приёма добавок .
Бетаин гидрохлорид или триметилглицерин, является важным кофактором и может выступать в качестве донора метильных групп. Следовательно, он способен оказывать влияние практически на любую клетку в организме человека. Он играет важную роль в репродуктивной функции. Бетаин гидрохлорид способствует увеличению процента подвижных сперматозоидов после процедур замораживания-оттаивания. При добавлении к питательной среде он благотворно влияет на развитие эмбриона in vitro. Транспорт бетаина активируется при оплодотворении. Перенос метильных групп способствует синтезу мелатонина, нейротрансмиттеров, таких как допамин и серотонин, а также коэнзима Q10.
Аминокислоты
Глутатион представляет собой трипептид. Он является одним из наиболее мощных антиоксидантов в организме человека. Его антиоксидантное действие заключается в восполнении тиольных групп, подвергшихся секвестрации под действием окислительного стресса . Глутатион стабилизирует среднюю часть сперматозоида и защищает мембрану клетки от перекисного окисления липидов . Даже у мужчин с варикоцеле при приёме добавки с глутатионом может отмечаться значительное улучшение параметров спермы.
L-карнитин , производное аминокислоты, одна из самых первых и самых эффективных пищевых добавок, использовавшихся у мужчин с изменениями в показателях спермы. Помимо того, что он играет важную роль в переносе энергии и энергетическом метаболизме, в частности, осуществляет транспорт жиров, которые затем расщепляются с выделением энергии, не вызывает сомнений тот факт, что карнитин также обладает антиоксидантными свойствами. В целом, значительные дозы карнитина способны повышать подвижность сперматозоидов, преимущественно обеспечивая увеличение энергии клеток . Ацетилкарнитин часто может быть полезен в качестве вспомогательного средства, улучшающего относительный метаболизм и биодоступность этих веществ.
L-метионин является серосодержащей незаменимой аминокислотой, активизирующей образование белка. За счёт своих промежуточных производных, он выступает в роли донора метильных групп, а также стимулятора синтеза карнитина. Он способствует синтезу фосфатидилхолина и других фосфолипидов, важных для поддержания целостности мембраны сперматозоида. При сравнении с контрольной группой, было обнаружено, что он предотвращает развитие нарушений акросомальной реакции и способствует сохранению целостности мембраны сперматозоида.
L-аргинин является очень важной аминокислотой. Он играет ключевую роль в профилактике сердечно-сосудистых событий. Он является предшественником оксида азота, сильнодействующего гормона, синтезирующегося локально и вызывающего расширение сосудов, улучшение циркуляции и, до некоторой степени, акросомальных реакций. Кроме того, аргинин обладает иммуномодулирующим действием, заключающимся в уменьшении воспалительного ответа и потенциальном снижении миграции лимфоцитов и цитокинов.
Лечении с использованием основной добавки для улучшения качества спермы (BSS – basic sperm supplement)
Некоторые микронутриенты при индивидуальном назначении в супрафизиологических дозах способны улучшать функцию спермы. Логично, что когда этот эффект был обнаружен, стали разрабатываться комбинированные добавки, обеспечивающие синергетические эффекты . Эти добавки способствуют поддержанию и улучшению показателей спермы, а также мужской фертильности в целом. Многокомпонентные препараты избавляют от необходимости принимать несколько разных таблеток и капсул.
Основные добавки для улучшения качества спермы представляют собой препараты, в состав которых входит ограниченное число витаминов, минералов и ферментов. Было показано, что они способны улучшать показатели спермы. Обычно основная добавка для улучшения качества спермы имеет в составе два витамина, три кофактора и три аминокислоты. Содержание их варьирует, однако, часто сравнимо с тем количеством, которое использовалось в исследованиях, подтверждающих эффективность добавки.
Научные исследования применения основных добавок для улучшения качества спермы показали положительные результаты. Было проанализировано 17 исследований, в которых приняло участие 665 мужчин, страдающих бесплодием, принимавших либо пероральные антиоксиданты, либо плацебо. Улучшение качества спермы наблюдалось в 14 из 17 исследований. Подвижность сперматозоидов увеличилась на 17%, а концентрация спермы – на 33% . В шести исследованиях отмечалось увеличение частоты наступления беременности. Также наблюдалось положительное влияние на целостность структуры ДНК и общие показатели окислительного стресса спермы . Наиболее значимой работой является обзор Кохрейна, в котором были проанализированы случаи 2867 пар, участвовавших в 34 исследованиях . Было обнаружено статистически значимое увеличение частоты наступления беременности и рождения живых детей у субфертильных пар.
Добавки также могут быть полезны пациентам, прибегающим к вспомогательным репродуктивным технологиям. В одном исследовании оценивалась эффективность добавки с антиоксидантами в улучшении функции спермы у пациентов, планирующих прибегнуть к ЭКО. Забор анализов производился исходно и через 12 месяцев, перед применением вспомогательных репродуктивных технологий. Образцы спермы были получены от 147 пациентов. Результаты анализа показали резкое увеличение показателей подвижности и общей численности сперматозоидов у пациентов с олигоастенотератозооспермией (ОАТ). Добавки с антиоксидантами оказывают выраженный положительный эффект у пациентов, планирующих ЭКО и имеющих изменения в показателях спермы.
Положительное влияние на сперматозоиды может оказать добавление антиоксидантов в питательную среду в процессе проведения ЭКО. Было показано, что эта процедура снижает окислительный стресс, возникающий вследствие физических манипуляций со сперматозоидами или криоконсервирования. Применение антиоксидантов может предотвратить повреждение хроматина спермы. Степень окислительного стресса в образцах спермы обратно пропорциональная частоте оплодотворения после ЭКО . Поэтому, добавление антиоксидантов к питательной среде может стать полезным приёмом .
Результаты применения запатентованной оптимизированной добавки для улучшения качества спермы (Optimized Sperm Supplement (OSS))
Оптимизированная добавка для улучшения качества спермы под названием Proceptin MX разрабатывалась для мужчин с нарушением репродуктивной функции и изменениями в показателях спермы. Это запатентованный препарат, представляющий собой нутрицевтик направленного действия. В его состав входят жиро- и водорастворимые антиоксиданты, аминокислоты и метаболические кофакторы. Целью его создания было обеспечение физиологической поддержки мужской репродуктивной функции (таблица). Эффективность этого препарата при снижении показателей наступления беременности и мужской субфертильности была оценена в научном исследовании.

В качестве контрольной группы выступали сами пациенты. Результаты, полученные после приёма OSS, сравнивались с исходными данными. В исследование вошли две группы пациентов: 1) мужчины с высокими индексами фрагментации ДНК (DFI), превышающими 30% и 2) мужчины, имеющие в анализе спермы хотя бы один измененный параметр. В группе 1 проводилось ретроспективное исследование, а в группе 2 – проспективное. В первую группу вошли 45 мужчин, а во вторую – 62. Все участники имели субфертильность неустановленной этиологии или необъяснимые изменения показателей анализа спермы. Все мужчины, у которых причины нарушения репродуктивной функции были очевидны, исключались из исследования.
В качестве референтных значений использовались нормы Всемирной организации здравоохранения. Для точного определения морфологии применялась оценка Крюгера.
Для выявления поверхностных антител использовался прямой иммуногранулотест. В качестве маркёра повреждения ДНК сперматозоида использовался индекс фрагментации ДНК (DFI), определявшийся при помощи анализа структуры хроматина сперматозоидов (SCSA - sperm chromatin structure assay).
Доза препарата составляла 1 капсулу в день при умеренных изменениях спермы и 2 капсулы – при более выраженных отклонениях от нормы. Лечение продолжалось не менее 3 месяцев. Такая продолжительность была выбрана исходя из длительности цикла сперматогенеза, периода, приблизительно равного 100 дням, требующимся для завершения этого процесса.
Результаты первой группы:
Результаты были весьма показательными. За 90 дней произошло улучшение показателя DFI на 10.2%. При последующем наблюдении было обнаружено увеличение численности сперматозоидов на 70% и подвижности – на 85%.
Во второй группе были получены следующие результаты:
1) Средний возраст составлял 38.0 лет.
2) Концентрация спермы выросла с 22.4 миллионов на мл до 38.3 миллионов на мл, что соответствует увеличению на 71%.
3) Подвижность сперматозоидов выросла с 32% до 46%, что соответствует увеличению на 43.8%.
4) Объём эякулята вырос с 2.6 мл до 4.3 мл, что соответствует увеличению на 39.5%.
5) Значимых изменений в результатах иммуногранулотеста не наблюдалось.
6) Показатели морфологии сперматозоидов выросли с 31.2% до 43.4% по критериям ВОЗ и с 6.1% до 8.6% по точным критериям Крюгера. Эти результаты не достигают статистической значимости, однако, была обнаружена закономерная связь между приёмом OSS и улучшением морфологии.
7) Клиническая беременность была диагностирована в 37% случаев, проходивших ЭКО.
8) Клиническая беременность была диагностирована в 18% случаев, в которых вспомогательные репродуктивные технологии не применялись.
Оценка результатов
Наблюдалась значимая корреляция между показателями выбранных биомаркёров в образцах спермы и приёмом добавок с микронутриентами. Полученные результаты подтверждают эффективность OSS в улучшении параметров анализа спермы и сокращении фрагментации ДНК.
Выводы
Мужская субфертильность, бесплодие и отклонение показателей спермы от нормы – довольно распространённые явления. Окислительный стресс, как было обнаружено, является значимым причинным фактором в нарушении функции спермы.
Было показано, что препарат, содержащий оптимизированные добавки для улучшения качества спермы, оказывает значимый эффект на репродуктивную функцию мужчины. При его применении наблюдалось улучшение функции спермы и снижение окислительного повреждения ДНК. Более того, клиническое исследование показало значительное улучшение показателей спермы и общей репродуктивной функции.
Использование пищевых добавок является логичным направлением в лечении, наряду с изменением диеты, образа жизни и условий внешней среды. Они не имеют побочных эффектов и противопоказаний. Комплаентность пациентов увеличивается благодаря тому, что все микронутриенты заключены в одну капсулу.
Целью разработки оптимизированной добавки для улучшения качества спермы является максимальное улучшение её функции. Приём оптимизированной добавки следует рекомендовать всем мужчинам с изменениями в показателях спермы или бесплодием неясной этиологии. Также имеет смысл использовать пищевые добавки в тех случаях, когда бесплодие предполагается у женщины. Это объясняется тем, что даже при нормальных показателях анализа спермы, в ней могут иметься невыявленные дефекты, такие как фрагментация ДНК.
Приём пищевых добавок необходимо продолжать не менее трёх месяцев, а предпочтительнее – вплоть до наступления беременности у женщины-партнёра. Оценка изменений в анализе спермы также предоставляет уникальную возможность проанализировать состояние здоровья мужчины в целом.
Продолжающие поступать клинические данные подтверждают выводы о том, что всем мужчинам, в том числе и не страдающим субфертильностью, следует принимать оптимизированную добавку для улучшения качества спермы. Такой подход позволит улучшить не только параметры репродуктивности, но и общие показатели наступления беременности и рождаемости. Для оптимизации данных по общей эффективности пищевых добавок для улучшения качества спермы требуется проведение продолжительных исследований.