Лекция Органические вещества. Белки Органические вещества - Лекция. Биология в лицее
Лекция 2. Органические вещества. Белки Органические вещества. О рганические соединения составляют в среднем 20–30% массы клетки живого организма. К ним относятся биологические полимеры – белки, нуклеиновые кислоты и полисахариды, а также жиры и ряд низкомолекулярных органических веществ – аминокислоты, простые сахара, нуклеотиды и т.д. Полимеры – сложные разветвленные или линейные молекулы, при гидролизе распадающиеся до мономеров . Если полимер состоит из одного вида мономеров, то такой полимер называют гомополимером , если в состав полимерной молекулы входят различные мономеры – то это гетерополимер . Если группа различных мономеров в полимерной молекуле повторяется (А,Б,В,А,Б,В,А,Б,В) – это регулярный гетерополимер , если нет повторения определенной группы мономеров – гетерополимер нерегулярный .Белки. Из органических веществ клетки по количеству и значению на первом месте стоят белки. Белки , или протеины (от греч. протос – первый, главный) – высокомолекулярные гетерополимеры, органические вещества и распадающиеся при гидролизе до аминокислот . Значение белков настолько велико, что информация о белках включена в два наиболее популярных определения Жизни: «Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка» (Ф.Энгельс). «Живые тела, существующие на Земле, представляют собой открытые, саморегулирующиеся и самовоспроизводящиеся системы, построенными из биополимеров – белков и нуклеиновых кислот» (М.В.Волькенштейн).В состав простых белков (состоящих только из аминокислот) входят углерод, водород, азот, кислород и сера . Часть белков (сложные белки) образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь – это сложные белки, содержащие помимо аминокислот еще и небелковую - простетическую группу . Она может быть представлена ионами металлов (металлопротеины - гемоглобин), углеводами (гликопротеины ), липидами (липопротеины ), нуклеиновыми кислотами (нуклеопротеины ).Белки обладают огромной молекулярной массой : Один из белков – глобулин молока – имеет молекулярную массу 42000. Его формула С 1864 Н 3012 О 576 N 468 S 21 . Существуют белки, молекулярная масса которых в 10 и даже в 100 раз больше. Для сравнения: молекулярная масса спирта – 46, уксусной кислоты – 60, бензола – 78.Белки представляют собой нерегулярные гетерополимеры , мономерами которых являются α-аминокислоты . В клетках и тканях обнаружено свыше 170 различных аминокислот, но в состав белков входит лишь 20 α-аминокислот . В зависимости от того, могут ли аминокислоты синтезироваться в организме, различают: заменимые аминокислоты – десять аминокислот, синтезируемых в организме и незаменимые аминокислоты – аминокислоты, которые в организме не синтезируются. Незаменимые аминокислоты должны поступать в организм вместе с пищей.В зависимости от аминокислотного состава, белки бывают полноценными , если содержат весь набор незаменимых аминокислот и неполноценными , если какие-то незаменимые аминокислоты в их составе отсутствуют.Общая формула аминокислот приведена на рисунке. Все α -аминокислоты при α -атоме углерода содержат атом водорода, карбоксильную группу (-СООН) и аминогруппу (-NH 2). Остальная часть молекулы представлена радикалом. А
Рис. 255. Амфотерные свойства аминокислот при различных рН.
Миногруппа легко присоединяет ион водорода, т.е. проявляет основные свойства. Карбоксильная группа легко отдает ион водорода – проявляет свойства кислоты. Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах. Это зависит от рН раствора и от того, какая аминокислота: нейтральная, кислая или основная. В
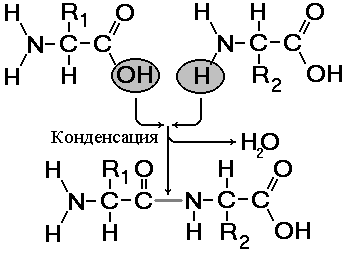
Рис. 256. Образование дипептида.
Зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу, основные аминокислоты, имеющие в радикале еще одну аминогруппу и кислые аминокислоты, имеющие в радикале еще одну карбоксильную группу. Пептиды – органические вещества, состоящие из небольшого количества остатков аминокислот, соединенных пептидной связью. Образование пептидов происходит в результате реакции конденсации аминокислот (рис.).При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой, между ними возникает ковалентная азот-углеродная связь, которую называют пептидной . В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов . Если полипептид состоит из большого количества остатков аминокислот, то его уже называют белком. На одном конце молекулы находится свободная аминогруппа (его называют N-концом), а на другом – свободная карбоксильная группа (его называют С-концом).Структура белковой молекулы. Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию . Выделяют 4 уровня пространственной организации белков.Первичная структура белка – последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами – пептидная.Е
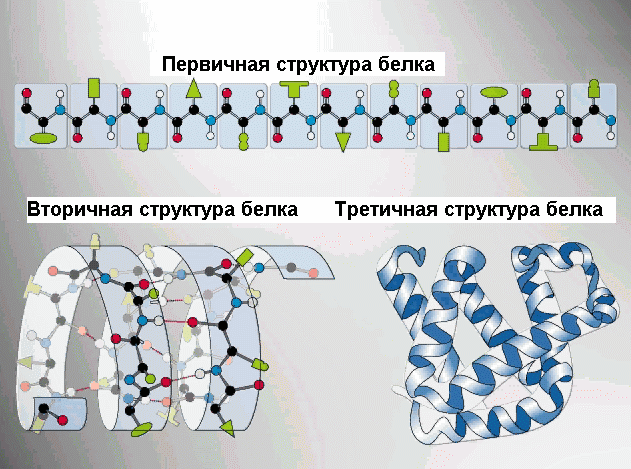
Сли молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот – 20 10 . Белки же, выделенные из живых организмов, образованы сотнями, а иногда и тысячами аминокислотных остатков.В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в -субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию – транспорт кислорода (в таких случаях у человека развивается заболевание – серповидноклеточная анемия).Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин. Исследования проводились в Кембриджском университете Ф.Сэнгером с 1944 по 1954 год. Было выявлено, что молекула инсулина состоит из двух полипептидных цепей (21 и 30 аминокислотных остатков), удерживаемых около друг друга дисульфидными мостиками. За свой кропотливый труд Ф.Сэнгер был удостоен Нобелевской премии.В
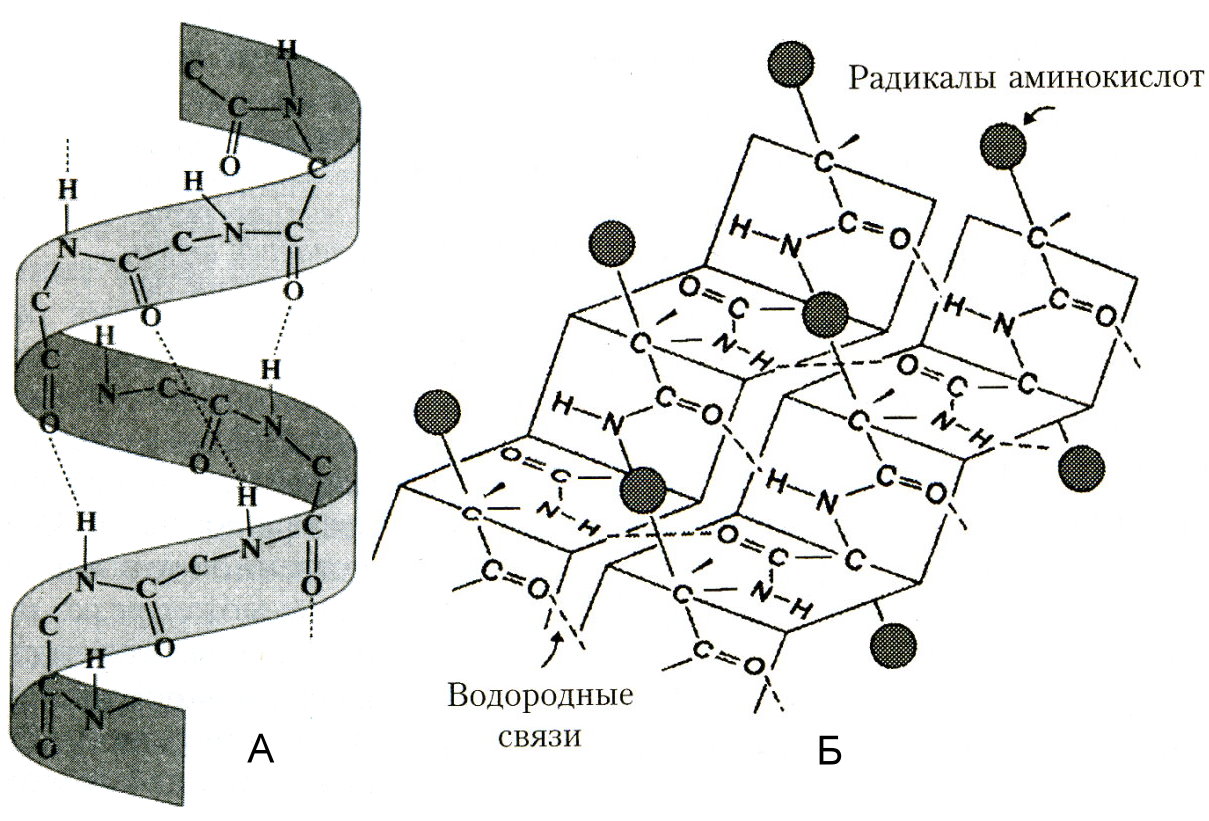
Рис. . Вторичные структуры белка
Торичная структура – упорядоченное свертывание полипептидной цепи в α-спираль (имеет вид растянутой пружины) и β-структра (складчатый слой) . В α- спирали NH -группа данного остатка аминокислоты взаимодействует с СО-группой четвертого от нее остатка. Практически все «СО-» и «NН-группы» принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).C кладчатый слой (синоним β-структра) формируется в том случае, если сегменты полипептидных цепей располагаются параллельно или антипараллельно друг другу в один слой. При этом образуется фигура, напоминающая лист, сложенный гармошкой.Т
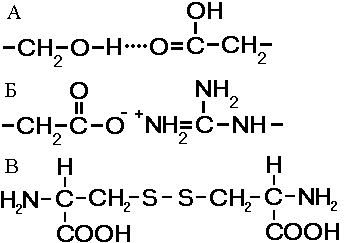
Рис. . Связи, стабилизирующие третичную структуру:
А - водородные, Б - ионные, В - дисульфидные.
Ретичная структура - укладка полипептидных цепей в глобулы , возникающей в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы.У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны. По форме молекулы различают белки глобулярные и фибриллярные. Если фибриллярные белки выполняют в основном опорные функции, то глобулярные белки растворимы и выполняют множество функций в цитоплазме клеток или во внутренней среде организма.Ч
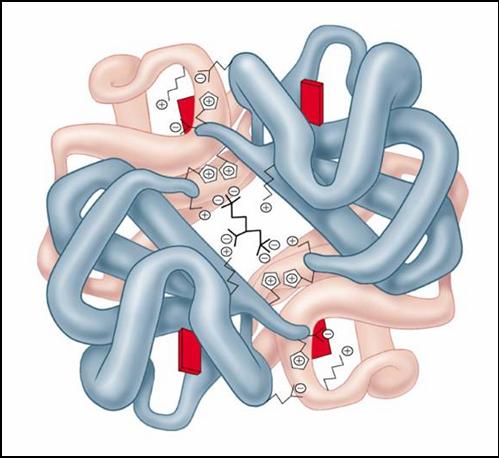
Рис. . Молекула гемоглобина
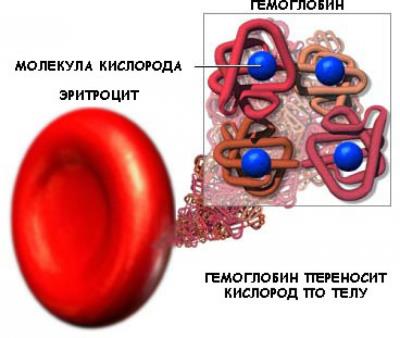
Етвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле исключительно при помощи нековалентных связей, в первую очередь водородных и гидрофобных.Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя -субъединицами (141 аминокислотный остаток) и двумя -субъединицами (146 аминокислотных остатков).С каждой субъединицей связана молекула гема, содержащая железо.М
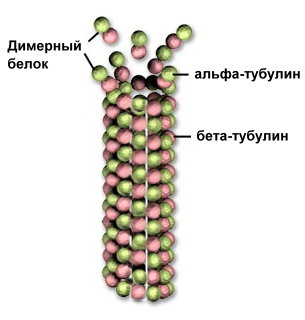
Рис. . Микротрубочка из тубулина
Ногие белки с четвертичной структурой занимают промежуточное положение между молекулами и клеточными органеллами – например микротрубочки цитоскелета состоят из белка тубулина , состоящего из двух субъединиц. Трубочка удлиняется в результате присоединения димеров к торцу.Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функцииСвойства белков. Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот, чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н + определяют буферные свойства белков, один из самых мощных буферов - гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне.Есть белки растворимые (фибриноген), есть нерастворимые , выполняющие механические функции (фиброин, кератин, коллаген).Есть белки активные в химическом отношении (ферменты), есть химически неактивные , устойчивые к воздействию различных условий внешней среды и крайне неустойчивые .В
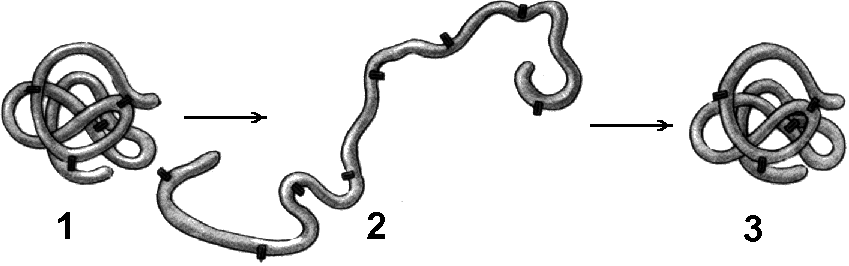
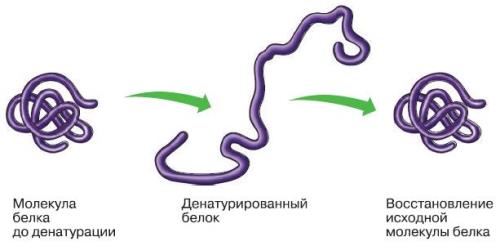
Рис. . Денатурация и ренатурация белка:
1 - молекула белка третичной структуры; 2 - денатурированный белок; 3 - восстановление третичной структуры в процессе ренатурации.
Нешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание) могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка без разрушения первичной структуры, называют денатурацией .Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций.Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой , в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией . Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой . Разрушение первичной структуры белка называется деградацией .Функции белков. Благодаря сложности, разнообразию форм и состава, белки играют важную роль в жизнедеятельности клетки и организма в целом. Функции их разнообразны.
| Функция | Примеры и пояснения |
| 1. Строительная | Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
| 2. Транспортная | Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
| 3. Регуляторная | Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
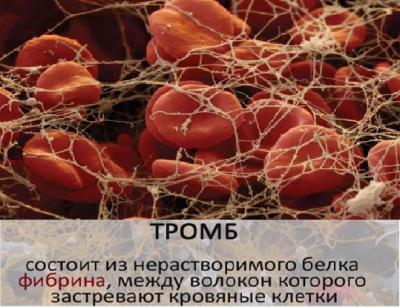
| 4. Защитная | В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки - антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений |
| 5. Двигательная | Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных |
| 6. Сигнальная | В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
| 7. Запасающая | В организме животных белки как правило не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется в организме, образуя комплекс с белком ферритином. |
| 8. Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов - воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
| 9. Каталитическая | Одна из важнейших функций белков. Обеспечивается белками - ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобисфосфаткарбоксилаза катализирует фиксацию СО 2 при фотосинтезе. |
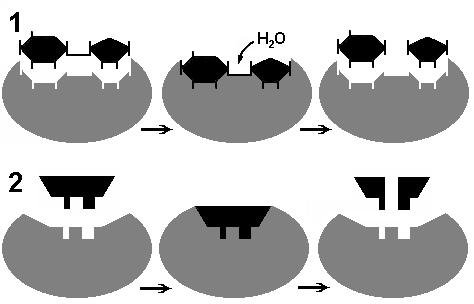
Соответствие фермента и субстрата:
1 - гипотеза «ключ – замок»; 2 - гипотеза «рука - перчатка».
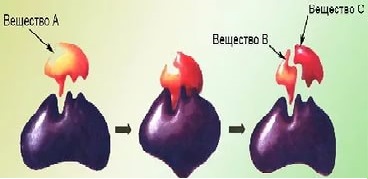
Арактерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция.Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э.Фишера (1890) и Д.Кошланда (1959). Э.Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с "ключом", фермент – с «замком».Д.Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия.Большинство неорганических катализаторов ускоряют химические реакции при очень высоких температурах, имеют максимальную эффективность в сильнокислой или сильнощелочной среде, при высоких давлениях, а большинство ферментов активны при температурах 35-45˚С, физиологических значениях кислотности раствора и при нормальном атмосферном давлении; скорость ферментативных реакций в десятки тысяч (а иногда и в миллионы раз) выше скорости реакций, идущих с участием неорганических катализаторов. Например, пероксид водорода без катализаторов разлагается медленно: 2Н 2 О 2 → 2Н 2 О + О 2 . В присутствии солей железа (катализатора) эта реакция идет несколько быстрее. Фермент каталаза (М=252000) за 1 сек. расщепляет 100 тыс. молекул Н 2 О 2 (М=34). Известно более 2000 различных ферментов, представленных белками с высокой молекулярной массой.Скорость ферментативных реакций зависит от 1) температуры, 2) концентрации фермента, 3) коцентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.Б
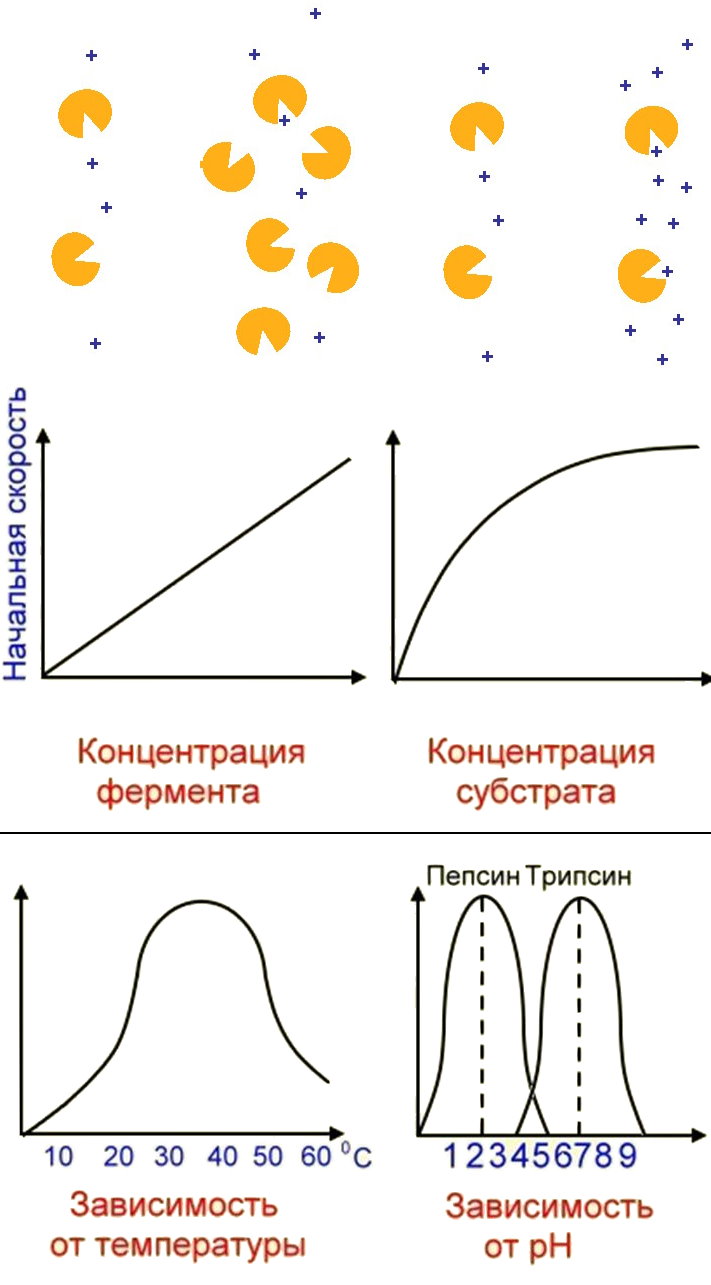
Рис. . Зависимость скорости реакции от концентрации фермента, субстрата, рН, температуры
Ольшинство ферментов может работать только при температуре от 0 о до 40 о С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10°С. При температуре выше 40°С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.При увеличении количества молекул субстрата скорость ферментативной реакции растет до тех пор, пока не произойдет насыщение активных центров фермента – если активный центр каталазы расщепляет в секунду 100 000 молекул субстрата, то при количестве молекул субстрата более 100 000 на активный центр скорость реакции не возрастет.Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин – 2,0, амилаза слюны – 6,8, липаза поджелудочной железы – 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.С

Рис. . Алостерическое активирование и ингибирование ферментов
Корость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами , если тормозят – ингибиторами .Классификация ферментов . По типу катализируемых химических превращений ферменты разделены на 6 классов: 1) оксиредуктазы (перенос атомов водорода, кислорода или электронов от одного вещества к другому – дегидрогеназа), 2) трансферазы (перенос метильной, ацильной, фосфатной или аминогруппы от одного вещества к другому – трансаминаза), 3) гидролазы (реакции гидролиза, при которых из субстрата образуются два продукта – амилаза, липаза), 4) лиазы (негидролитическое присоединение к субстрату или отщепление от него группы атомов, при этом могут разрываться связи «С-С», «С-N», «С-О», «С-S» – декарбоксилаза), 5) изомеразы (внутримолекулярная перестройка – изомераза), 6) лигазы (соединение двух молекул в результате образования связей «С-С», «С-N», «С-О», «С-S» – синтетазаКлючевые термины и понятия 1. Полимеры, гомо- и гетерополимеры. 2. Регулярные и нерегулярные гетерополимеры. 2. Простые белки. 3. Простетическая группа. 4. α- аминокислоты. 5. Заменимые и незаменимые аминокислоты. 6. Полноценные и неполноценные белки. 7. Пептидная связь. 8. Первичная структура белка. 9. Вторичная структура белка. 10. Третичная структура белка. 11. Четвертичная структура белка. 12. Денатурация, ренатурация, деградация. 13. Активный центр фермента. 14. Аллостерический центр фермента.Основные вопросы для повторения
Какие органические молекулы относятся к биополимерам?
Какие химические элементы входят в состав простых белков.
Почему белки относят к нерегулярным гетерополимерам?
Сколько различных белков может быть построено из 10 аминокислот?
Основные свойства белков.
Характеристика основных функций, которые выполняют белки в организме.
Почему ферменты специфичны?
От чего зависит скорость ферментативных реакций?
Как работает фермент каталаза?
Белки (протеины , полипептиды ) - самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. В состав молекул белков входят атомы углерода, кислорода, водорода, азота и иногда серы, фосфора и железа.
Мономерами белков являются аминокислоты , которые(имея в своём составе карбоксильную и амино- группы)обладают свойствами кислоты и основания (амфотерны).
Благодаря этому аминокислоты могут соединяться друг с другом (их количество в одной молекуле может достигать нескольких сотен). В связи с этим молекулы белков имеют большие размеры и их называют макромолекулами .

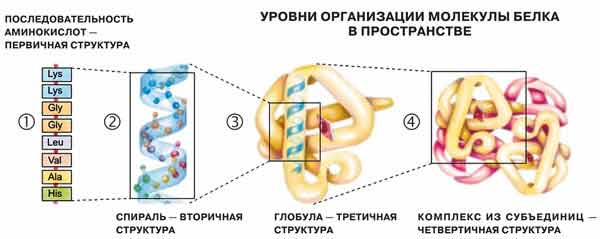
Структура белковой молекулы
Под структурой белковой молекулы понимают ее аминокислотный состав, последовательность мономеров и степень скрученности молекулы белка.
В молекулах белков встречается всего 20 видов различных аминокислот и огромное разнообразие белков создается за счет различного их сочетания.
- Последовательность аминокислот в составе полипептидной цепи - это первичная структура белка (она уникальна для любого белка и определяет его форму, свойства и функции). Первичная структура белка уникальна для любого типа белка и определяет форму его молекулы, его свойства и функции.
- Длинная молекула белка сворачивается и приобретает сначала вид спирали в результате образования водородных связей между -СО и -NН группами разных аминокислотных остатков полипептидной цепи (между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты). Эта спираль - вторичная структура белка .
- Третичная структура белка - трёхмерная пространственная “упаковка” полипептидной цепи в виде глобулы (шарика). Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот (гидрофобными, водородными, ионными и дисульфидными S-S связями).
- Некоторые белки (например, гемоглобин крови человека) имеют четвертичную структуру. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Четвертичная структура удерживается непрочными ионными, водородными и гидрофобными связями.
Структура белков может нарушаться (подвергаться денатурации ) при нагревании, обработке некоторыми химическими веществами, облучении и др. При слабом воздействии распадается только четвертичная структура, при более сильном - третичная, а затем - вторичная, и белок остается в виде полипептидной цепи. В результате денатурации белок теряет способность выполнять свою функцию.
Нарушение четвертичной, третичной и вторичной структур обратимо. Этот процесс называют ренатурацией .
Разрушение первичной структуры необратимо.
Кроме простых белков, состоящих только из аминокислот, есть еще и сложные белки, в состав которых могут входить углеводы (гликопротеины ), жиры (липопротеины ), нуклеиновые кислоты (нуклеопротеины ) и др.
Функции белков
- Каталитическая (ферментативная) функция. Специальные белки - ферменты - способны ускорять биохимические реакции в клетке в десятки и сотни миллионов раз. Каждый фермент ускоряет одну и только одну реакцию. В состав ферментов входят витамины.
- Структурная (строительная) функция - одна из основных функций белков (белки входят в состав клеточных мембран; белок кератин образует волосы и ногти; белки коллаген и эластин – хрящи и сухожилия).
![]()
- Транспортная функция - белки обеспечивают активный транспорт ионов через клеточные мембраны (транспортные белки в наружной мембране клеток), транспорт кислорода и углекислого газа (гемоглобин крови и миоглобин в мышцах), транспорт жирных кислот (белки сыворотки крови способствуют переносу липидов и жирных кислот, различных биологически активных веществ).
- Сигнальная функция . Прием сигналов из внешней среды и передача информации в клетку происходит за счёт встроенных в мембрану белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды.
- Сократительная (двигательная) функция - обеспечивается сократительными белками – актином и миозином (благодаря сократительным белкам двигаются реснички и жгутики у простейших, перемещаются хромосомы при делении клетки, сокращаются мышцы у многоклеточных, совершенствуются другие виды движения у живых организмов.

- Защитная функция - антитела обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь, образуя тромб.
- Регуляторная функция присуща белкам - гормонам (не все гормоны являются белками!). Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах (например, инсулин регулирует содержание сахара в крови).
- Энергетическая функция - при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры (при полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии). Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Органические соединения. Белки.
Белки - обязательная составная часть всех клеток. В жизни всех организмов белки имеют первостепенное значение. В состав белка входят углерод, водород, азот, некоторые белки содержат еще и серу. Роль мономеров в белках играют аминокислоты. У каждой аминокислоты имеется карбоксильная группа (-СООН) и аминогруппа (-NH 2). Наличие в одной молекуле кислотной и основной групп обусловливает их высокую реактивность. Между соединившимися аминокислотами возникает связь называемая пептидной , а образовавшееся соединение нескольких аминокислот называют пептидом . Соединение из большого числа аминокислот называют полипептидом . В белках встречаются 20 аминокислот, отличающихся друг от друга своим строением. Разные белки образуются в результате соединения аминокислот в разной последовательности. Огромное разнообразие живых существ в значительной степени определяется различиями в составе имеющихся у них белков.
В строении молекул белков различают четыре уровня организации:
Первичная структура - полипептидная цепь из аминокислот, связанных в определенной последовательности ковалентными (прочными) пептидными связями.
Вторичная структура - полипептидная цепь, закрученная в виде спирали. В ней между соседними витками возникают мало прочные водородные связи. В комплексе они обеспечивают довольно прочную структуру.
Третичная структура представляет собой причудливую, но для каждого белка специфическую конфигурацию - глобулу. Она удерживается мало прочными гидрофобными связями или силами сцепления между неполярными радикалами, которые встречаются у многих аминокислот. Благодаря их многочисленности они обеспечивают достаточную устойчивость белковой макромолекулы и ее подвижность. Третичная структура белков поддерживается также ковалентными S-S-связями возникающими между удаленными друг от друга радикалами серосодержащей аминокислоты - цистеина.
Благодаря соединению нескольких молекул белков между собой образуется четвертичная структура. Если пептидные цепи уложены в виде клубка, то такие белки называются глобулярными . Если полипептидные цепи уложены в пучки нитей, они носят название фибриллярных белков .
Нарушение природной структуры белка называют денатурацией . Она может возникать под действием высокой температуры, химических веществ, радиации и т.д. Денатурация может быть обратимой (частичное нарушение четвертичной структуры) и необратимой (разрушение всех структур).
ФУНКЦИИ:
Биологические функции белков в клетке чрезвычайно многообразны. Они в значительной мере обусловлены сложностью и разнообразием форм и состава самих белков.
1 Строительная функция- построены оргонойды.
2 Каталитическая- белки ферменты.(амилаза,превращает крахмал в глюкозу)
3 Энергетическая- белки могут служить источником энергии для клетки. При недостатке углеводов
или жиров окисляются молекулы аминокислот. Освободившаяся при этом энергия используется на поддержание процессов жизнедеятельности организма.
4 Транспортная – гемоглобин (переносит кислород)
5 Сигнальная –рецепторные белки участвуют в обрзовании нервного импульса
6 Защитная – антитела белки
7 Яды,гормоны- это тоже белки (инсулин, регулирует потребление глюкозы)
ВОПРОС 2. ЗАДАЧА.
БИЛЕТ№4
ВОПРОС 1.
Биополимеры - белки. Полимеры - высокомалекулярные соединения состоящие из молекул мономеров. Мономеры - низкомалеккулярные соединения. Регулярные полимеры - молекула состоит из мономеров одного вида. Нерегулярные полимеры - молекула состоит из мономеров нескольких видов. Белки- это нерегулярные полимеры, мономерами которых являются аминокислоты. Аминокислот – 20 видов из них 8 незаменимые, не синтезируются в организме человека, а поступают в него вместе с пищей.
Нуклеиновые кислоты. Различают два типа нуклеиновых кислот - дезоксирибонуклеиновые (ДНК) и рибонуклеиновые (РНК). Эти биополимеры состоят из мономеров, называемых нуклеотидами. Мономеры-нуклеотиды ДНК и РНК сходны в основных чертах строения. Каждый нуклеотид состоит из трех компонентов, соединенных прочными химическими связями.
РНК, содержат пяти-углеродный сахар - рибозу, одно из четырех органических соединений, которые называют азотистымиоснованиями: аденин, гуанин, цитозин, урацил(А, Г, Ц, У) - и остаток фосфорной кислоты.
Нуклеотиды, входящие в состав ДНК, содержат пяти-углеродный сахар - дезоксирибозу, одно из четырех азотистых оснований: аденин, гуанин, цитозин, тимин (А, Г, Ц, Т)-и остаток фосфорной кислоты.
В составе нуклеотидов к молекуле рибозы (или дезокси-рибозы) с одной стороны присоединено азотистое основание, а с другой - остаток фосфорной кислоты. Нуклеотиды соединяются между собой в длинные цепи. Остов такой цепи образуют регулярно чередующиеся остатки сахара и органических фосфатов, а боковые группы этой цепи - четыре типа нерегулярно чередующихся азотистых оснований.
Молекула ДНК представляет собой структуру, состоящую из двух нитей, которые по всей длине соединены друг с другом водородными связями. Такую структуру, свойственную только молекулам ДНК, называют двойной спиралью . Особенностью структуры ДНК является то, что против азотистого основания А в одной цепи лежит азотистое основание Т в другой цепи, а против азотистого основания Гвсегда расположено азотистое основаниеЦ.
А (аденин) - Т (тимин) Т (тимин) - А (аденин) Г (гуанин) - Ц (цитозин) Ц (цитозин) -Г (гуанин)
Эти пары оснований называют комплиментарными основаниями (дополняющими друг друга). Нити ДНК, в которых основания расположены комплементарно друг другу» называют комплиментарными нитями.
Расположение четырех типов нуклеотидов в цепях ДНК несет важную информацию. Порядок расположения нуклеотидов в молекулах ДНК определяет порядок расположения аминокислот в линейных молекулах белков, т.е. их первичную структуру. Набор белков (ферментов, гормонов и др.) определяет свойства клетки и организма. Молекулы ДНК хранят сведения об этих свойствах и передают их в поколения потомков. Другими словами, ДНК является носителем наследственной информации. Молекулы ДНК в основном находятся в ядрах клеток. Однако небольшое их количество содержится в митохондриях и хлоропластах.
Основные виды РНК. Наследственная информация, хранящаяся в молекулах ДНК, реализуется через молекулы белков. Информация о строении белка считывается с ДНК и передается особыми молекулами РНК, которые называются информационными (и-РНК). Информационная РНК переносится в цитоплазму, где с помощью специальных органоидов - рибосом - идет синтез белка. Именно информационная РНК, которая строится комплементарно одной из нитей ДНК, определяет порядок расположения аминокислот в белковых молекулах. В синтезе белка принимает участие другой вид РНК - транспортная (т-РНК), которая подносит аминокислоты к рибосомам. В состав рибосом входит третий вид РНК, так называемая рибосомная РНК (р-РНК), которая определяет структуру рибосом. Молекула РНК в отличие от молекулы ДНК представлена одной нитью; вместо дезоксирибозы - рибоза и вместо тимина - урацил. Значение РНК определяется тем, что они обеспечивают синтез в клетке специфических для нее белков.
Удвоение ДНК. Перед каждым клеточным делением при абсолютно точном соблюдении нуклеотидной последовательности происходит самоудвоение (редупликация) молекулы ДНК. Редупликация начинается с того, что двойная спираль ДНК временно раскручивается. Это происходит под действием фермента ДНК-полимеразы в среде, в которой содержатся свободные нуклеотиды. Каждая одинарная цепь по принципу химического сродства (А-Т, Г-Ц) притягивает к своим нуклеотидным остаткам и закрепляет водородными связями свободные нуклеотиды, находящиеся в клетке. Таким образом, каждая полинуклеотидная цепь выполняет роль матрицы для новой комплиментарной цепи. В результате получаются две молекулы ДНК, у каждой из них одна половина происходит от родительской молекулы, а другая является вновь синтезированной, т.е. две новые молекулы ДНК представляют собой точную копию исходной молекулы.
ВОПРОС 2. ЗАДАЧА.
ВОПРОС 1.
Аденозинфосфорные кислоты . Особо важную роль в биоэнергетике клетки играет адениловый нуклеотид, к которому присоединены два остатка фосфорной кислоты. Такое вещество называют аденозинтрифосфорной кислотой (АТФ). В химических связях между остатками фосфорной кислоты молекулы АТФ запасена энергия, которая освобождается при отщеплении органического фосфата: АТФ = АДФ +Ф+Е, где Ф - фермент, Е - освобождающаяся энергия.
В этой реакции образуется аденозиндифосфорная кислота (АДФ) - остаток молекулы АТФ и органический фосфат. Энергию АТФ все клетки используют для процессов биосинтеза, движения, производства тепла, нервных импульсов, свечений (например, у люминесцентных бактерий), т.е. для всех процессов жизнедеятельности.
АТФ - универсальный биологический аккумулятор энергии. Световая энергия Солнца и энергия, заключенная в потребляемой пище, запасается в молекулах АТФ. Запас АТФ в клетке невелик. Так, в мышце запаса АТФ хватает на 20-30 сокращений. При усиленной, но кратковременной работе мышцы работают исключительно за счет расщепления содержащейся в них АТФ. После окончания работы человек усиленно дышит - в этот период происходит расщепление углеводов и других веществ (происходит накопление энергии) и запас АТФ в клетках восстанавливается.
Митохондрии окружены наружной мембраной и, следовательно, уже являются компартментом, будучи отделенными от окружающей цитоплазмы; кроме того, внутреннее пространство митохондрий также подразделено на два компартмента с помощью внутренней мембраны. Наружная мембрана митохондрий очень похожа по составу на мембраны эндоплазматической сети; внутренняя мембрана митохондрий, образующая складки (кристы), очень богата белками - пожалуй, эта одна из самых насыщенных белками мембран в клетке; среди них белки «дыхательной цепи», отвечающие за перенос электронов; белки-переносчики для АДФ, АТФ, кислорода, СО у некоторых органических молекул и ионов. Продукты гликолиза, поступающие в митохондрии из цитоплазмы, окисляются во внутреннем отсеке митохондрий.
Белки, отвечающие за перенос электронов, расположены в мембране так, что в процессе переноса электронов протоны выбрасываются по одну сторону мембраны - они попадают в пространство между наружной и внутренней мембраной и накапливаются там. Это приводит к возникновению электрохимического потенциала (вследствие разницы в концентрации и зарядах). Эта разница поддерживается благодаря важнейшему свойству внутренней мембраны митохондрии - она непроницаема для протонов. То есть при обычных условиях сами по себе протоны пройти сквозь эту мембрану не могут. Но в ней имеются особые белки, точнее белковые комплексы, состоящие из многих белков и формирующие канал для протонов. Протоны проходят через этот канал под действием движущей силы электрохимического градиента. Энергия этого процесса используется ферментом, содержащимся в тех же самых белковых комплексах и способным присоединить фосфатную группу к аденозиндифосфату (АДФ), что и приводит к синтезу АТФ.
Митохондрия, таким образом, исполняет в клетке роль «энергетической станции». Принцип образования АТФ в хлоропластах клеток растений в общем тот же - использование протонного градиента и преобразование энергии электрохимического градиента в энергию химических связей.
ВОПРОС 2. ЗАДАЧА.
БИЛЕТ№ 6
ВОПРОС 1.
Клетка - элементарная единица живой системы. Элементарной единицей она может быть названа потому, что в природе нет более мелких систем, которым были бы присущи все без исключения признаки (свойства) живого. Известно, что организмы бывают одноклеточными (например, бактерии, простейшие, водоросли) или многоклеточными. Клетка обладает всеми свойствами живой системы: она осуществляет обмен веществ и энергии, растет, размножается и передает по наследству свои признаки, реагирует на внешние раздражители и способна двигаться. Она является низшей ступенью организации, обладающей всеми этими свойствами. Клетка, по существу, представляет собой самовоспроизводящуюся химическую систему. Для того, чтобы поддерживать в себе необходимую концентрацию химических веществ, эта система должна быть физически отделена от своего окружения, и вместе с тем она должна обладать способностью к обмену с этим окружением, т.е. способностью поглощать те вещества, которые требуются ей в качестве « сырья », и выводить наружу накапливающиеся « отходы ». Роль барьера между данной химической системой и ее окружением играет плазматическая мембрана. Она помогает регулировать обмен между внутренней и внешней средой и, таким образом, служит границей клетки.
Функции в клетке распределены между различными органоидами, такими, как клеточное ядро, митохондрии и т.д. У многоклеточных организмов разные клетки (например, нервные, мышечные, клетки крови у животных или клетки стебля, листьев, корня у растений) выполняют разные функции и поэтому различаются по структуре. Несмотря на многообразие форм, клетки разных типов обладают поразительным сходством главных структурных особенностей. В качестве единого целого клетка реагирует и на воздействие внешней среды. При этом одна из ее особенностей как целостной системы - обратимость некоторых происходящих в ней процессов. Например, после того как клетка отреагировала на внешние воздействия, она возвращается к исходному состоянию. В ней сосредоточена наследственная информация, обеспечивающая сохранность вида и разнообразие особей.
Строение растительной клетки: целлюлозная оболочка, мембрана, цитоплазма с органоидами, ядро, вакуоли с клеточным соком. Наличие пластид - главная особенность растительной клетки.
Функции клеточной оболочки - определяет форму клетки, защищает от факторов внешней среды.
Плазматическая мембрана - тонкая пленка, состоит из взаимодействующих молекул липидов и белков, отграничивает внутреннее содержимое от внешней среды, обеспечивает транспорт в клетку воды, минеральных и органических веществ путем осмоса и активного переноса, а также удаляет продукты жизнедеятельности.
Цитоплазма - внутренняя полужидкая среда клетки, в которой расположено ядро и органоиды, обеспечивает связи между ними, участвует в основных процессах жизнедеятельности.
Эндоплазматическая сеть - сеть ветвящихся каналов в цитоплазме. Она участвует в синтезе белков, липидов и углеводов, в транспорте веществ. Рибосомы - тельца, расположенные на ЭПС или в цитоплазме, состоят из РНК и белка, участвуют в синтезе белка. ЭПС и рибосомы - единый аппарат синтеза и транспорта белков.
Митохондрии - органоиды, отграниченные от цитоплазмы двумя мембранами. В них окисляются органические вещества и синтезируются молекулы АТФ с участием ферментов. Увеличение поверхности внутренней мембраны, на которой расположены ферменты за счет крист. АТФ - богатое энергией органическое вещество.
Пластиды (хлоропласты, лейкопласты, хромопласты), их содержание в клетке - главная особенность растительного организма. Хлоропласты - пластиды, содержащие зеленый пигмент хлорофилл, который поглощает энергию света и использует ее на синтез органических веществ из углекислого газа и воды. Отграничение хлоропластов от цитоплазмы двумя мембранами, многочисленные выросты - граны на внутренней мембране, в которых расположены молекулы хлорофилла и ферменты.
Комплекс Гольджи - система полостей, отграниченных от цитоплазмы мембраной. Накапливание в них белков, жиров и углеводов. Осуществление на мембранах синтеза жиров и углеводов.
Лизосомы - тельца, отграниченные от цитоплазмы одной мембраной. Содержащиеся в них ферменты ускоряют реакцию расщепления сложных молекул до простых: белков до аминокислот, сложных углеводов до простых, липидов до глицерина и жирных кислот, а также разрушают отмершие части клетки, целые клетки.
Вакуоли - полости в цитоплазме, заполненные клеточным соком, место накопления запасных питательных веществ, вредных веществ; они регулируют содержание воды в клетке.
Ядро - главная часть клетки, покрытая снаружи двух мембранной, пронизанной порами ядерной оболочкой. Вещества поступают в ядро и удаляются из него через поры. Хромосомы - носители наследственной информации о признаках организма, основные структуры ядра, каждая из которых состоит из одной молекулы ДНК в соединении с белками. Ядро - место синтеза ДНЯ, иРНК, рРНК.Строение животной клетки - наличие наружной мембраны, цитоплазмы с органоидами, ядра с хромосомами.
Наружная, или плазматическая, мембрана - отграничивает содержимое клетки от окружающей среды (других клеток, межклеточного вещества), состоит из молекул липидов и белка, обеспечивает связь между клетками, транспорт веществ в клетку (пиноцитоз, фагоцитоз) и из клетки.
Цитоплазма - внутренняя полужидкая среда клетки, которая обеспечивает связь между расположенными в ней ядром и органоидами. В цитоплазме протекают основные процессы жизнедеятельности.
Органоиды клетки:
1) эндоплазматическая сеть (ЭПС) - система ветвящихся канальцев, участвует в синтезе белков, ли-пидов и углеводов, в транспорте веществ в клетке;
2) рибосомы - тельца, содержащие рРНК, расположены на ЭПС и в цитоплазме, участвуют в синтезе белка. ЭПС и рибосомы - единый аппарат синтеза и транспорта белка;
3) митохондрии - «силовые станции» клетки, отграничены от цитоплазмы двумя мембранами. Внутренняя образует кристы (складки), увеличивающие ее поверхность. Ферменты на кристах ускоряют реакции окисления органических веществ и синтеза молекул АТФ, богатых энергией;
4) комплекс Гольджи - группа полостей, отграниченных мембраной от цитоплазмы, заполненных белками, жирами и углеводами, которые либо используются в процессах жизнедеятельности, либо удаляются из клетки. На мембранах комплекса осуществляется синтез жиров и углеводов;
5) лизосомы - тельца, заполненные ферментами, ускоряют реакции расщепления белков до аминокислот, липидов до глицерина и жирных -.кислот, полисахаридов до моносахаридов. В лизосомах разрушаются отмершие части клетки, целые и клетки.
Клеточные включения - скопления запас- иных питательных веществ: белков, жиров и углеводов.
Ядро - наиболее важная часть клетки. Оно покрыто двухмембранной оболочкой с порами, через которые одни вещества проникают в ядро, а Другие поступают в цитоплазму. Хромосомы - основные структуры ядра, носители наследственной информации о признаках организма. Она передается в процессе деления материнской клетки дочерним клеткам, а с половыми клетками - дочерним
организмам. Ядро - место синтеза ДНК. иРНК, рРНК.
ВОПРОС 2. ЗАДАЧА.
БИЛЕТ№ 7
Из органических веществ, клетки на первом месте по количеству и значению стоят белки. Белки или протеины – это вещества, содержащие углерод, водород, кислород, азот и обычно также серу и фосфор. Белкам присуща громадная молекулярная масса. Например, молекулярная масса гемоглобина – белка красных кровяных клеток – 152000, миозина – белок мышц – 500000. Такие молекулы называются макромолекулами.
Строение белков. Среди органических соединений белки самые сложные. Они относятся к высокомолекулярным соединениям – биополимерам, веществам, молекулы состоят из многократно повторяющихся структурных единиц. Белки – непериодические полимеры, мономерами которых являются аминокислоты.
Белки животных организмов состоят главным образом из аминокислот (обычно 20) и при гидролизе распадаются на аминокислоты. Белки – важнейшая составная часть живых организмов: все ферменты, некоторые гормоны и антибиотики относятся к белкам.
Роль белка в жизни клеток организмов:
1) белки – строительный материал организма (оболочки, мембраны, органоиды);
2) каталитическая функция – ферменты, ускоряющие реакции в сотни миллионов раз;
3) двигательная функция – движение жгутиковых, инфузорий, сокращение мышц;
4) транспортная функция – гемоглобины крови;
5) защитная – антитела крови;
6) энергетическая функция - при расщеплении 1 г белков освобождается 17,6 кДж энергии.
Важным этапом в исследовании строения белка явилось установление в них пептидной связи, образованной из карбонильной группы и аминогруппы, входящих в состав различных амикокислот. Впервые важная роль группы -NH-CО - в построении белковой молекулы отмечена А.Д.Данилевским (1888 г).
Из различных аминокислот только a -аминокислоты могут образовывать дипептиды. Например: из a-аминокислот глицина и аланина образуется дипептид – глицил-аланин:
В зависимости от числа аминокислотных остатков, входящих в состав молекулы полипептида, различают ди-, три- и т.д. полипептиды.
Установление последовательности расположения аминокислотных остатков в одной или нескольких полипептидных цепях, составляющих молекулу белка, является первоначальной целью при исследовании его структуры. В строении молекул белков различают четыре уровня организации:
1) первичная структура – полипептидная цепь из аминокислот, связанных в определенной последовательности пептидными связями;
2) вторичная структура – полипептидная цепь в виде спирали. Между пептидными связями соседних витков и другими атомами возникают многочисленные водородные связи, обеспечивающие прочную структуру;
3) третичная структура – специфическая для каждого белка конфигурация в виде глобулы;
4) четвертичная структура возникает при соединении нескольких макромолекул, образующих агрегаты.
Нарушение природной структуры белка называется денатурацией, под воздействием высокой температурь, химических веществ, света.
Белки являются биологическими полимерами со сложнейшей структурой. Они имеют высокий молекулярный вес и состоят из аминокислот, простетических групп, представленных витаминами, липидных и углеводных включений. Белки, содержащие углеводы, витамины, металлы или липиды, называются сложными. Простые белки состоят только из аминокислот, соединенных между собой пептидной связью.
Пептиды
Независимо от того, какую структуру имеет вещество, мономерами белков являются аминокислоты. Они образуют базовую полипептидную цепочку, из которой затем формируется фибриллярная или глобулярная структура белка. При может синтезироваться только в живой ткани - в растительных, бактериальных, грибковых, животных и прочих клетках.
Единственными организмами, которые не могут соединять мономеры белков, являются вирусы и простейшие бактерии. Все остальные способны образовывать структурные белки. Но какие вещества являются мономерами белков, и как они образуются? Об этом и о о полипептидах и образовании сложной белковой структуры, об аминокислотах и их свойствах читайте ниже.
Единственным мономером молекулы белка служит любая альфа-аминокислота. При этом белок - это полипептид, цепочка из соединенных аминокислот. В зависимости от количества аминокислот, участвующих в его образовании, выделяют дипептиды (2 остатка), трипептиды (3), олигопептиды (содержит от 2-10 аминокислот) и полипептиды (множество аминокислот).
Обзор структуры белков
Структура белка может быть первичной, чуть более сложной - вторичной, еще более сложной - третичной, и самой сложной - четвертичной.
Первичная структура - это простая цепь, в которую посредством пептидной связи (CO-NH) соединены мономеры белков (аминокислоты). Вторичная структура - это альфа-спираль или бета-складки. Третичная - это еще более усложненная трехмерная структура белка, которая образовалась из вторичной вследствие образования ковалентных, ионных и водородных связей, а также гидрофобных взаимодействий.
Четвертичная структура является самой сложной и свойственна рецепторным белкам, расположенным на клеточных мембранах. Это надмолекулярная (доменная) структура, образованная вследствие объединения нескольких молекул с третичной структурой, дополненных углеводными, липидными или витаминными группами. В данном случае, как и при первичной, вторичной и третичной структурах, мономерами белков являются альфа-аминокислоты. Они также соединены пептидными связями. Отличие состоит лишь в сложности структуры.
Аминокислоты
Единственными мономерами молекул белков являются альфа-аминокислоты. Их всего 20, и они являются чуть ли не основой жизни. Благодаря появлению пептидной связи, стал возможным. А сам белок после этого начал выполнять структурообразующую, рецепторную, ферментативную, транспортную, медиаторную и прочие функции. Благодаря этому живой организм функционирует и способен воспроизводиться.
Сама альфа-аминокислота представляет собой органическую карбоновую кислоту с аминогруппой, соединенной с альфа-углеродным атомом. Последний расположен рядом с карбоксильной группой. При этом мономеры белков рассматриваются как у которых концевой углеродный атом несет и аминную, и карбоксильную группу.
Соединение аминокислот в пептидах и белках
Аминокислоты соединяются в димеры, тримеры и полимеры посредством пептидной связи. Она образуется путем отщепления гидроксильной (-ОН) группы от карбоксильного участка одной альфа-аминокислоты и водорода (-Н) - от аминогруппы другой альфа-аминокислоты. В результате взаимодействия отщепляется вода, а на карбоксильном конце остается участок С=О со свободным электроном около углерода карбоксильного остатка. В аминогруппе другой кислоты имеется остаток (NH) с имеющимся у азотного атома. Это позволяет соединить два радикала с образованием связи (CONH). Она называется пептидной.
Варианты альфа-аминокислот
Всего известно 23 альфа-аминокислоты. Они представлены в виде списка: глицин, валин, аланин, изолецин, лейцин, глутамат, аспарагинат, орнитин, треонин, серин, лизин, цистин, цистеин, фенилаланин, метионин, тирозин, пролин, триптофан, оксипролин, аргинин, гистидин, аспарагин и глутамин. В зависимости от того, могут ли они синтезироваться организмом человека, эти аминокислоты делятся на заменимые и незаменимые.
Понятие о заменимых и незаменимых аминокислотах
Заменимые организм человека может синтезировать, тогда как незаменимые должны поступать только с пищей. При этом и незаменимые, и заменимые кислоты важны для биосинтеза белка, потому как без них синтез не может быть завершен. Без одной аминокислоты, даже если все остальные присутствуют, невозможно построить именно тот белок, который требуется клетке для выполнения своих функций.
Одна ошибка на любом из этапов биосинтеза - и белок уже непригоден, потому как не сможет собраться в нужную структуру из-за нарушения электронных плотностей и межатомных взаимодействий. Потому человеку (и прочим организмам) важно потреблять в которых имеются незаменимые аминокислоты. Их отсутствие в пище приводит к ряду нарушений белкового обмена.
Процесс образования пептидной связи
Единственными мономерами белков являются альфа-аминокислоты. Они постепенно соединяются в цепочку полипетида, структура которой заранее сохранена в ДНК (или РНК, если рассматривается бактериальный биосинтез). При этом белок - это строгая последовательность аминокислотных остатков. Это цепочка, упорядоченная в определенную структуру, выполняющая в клетке заранее запрограммированную функцию.
Этапная последовательность белкового биосинтеза
Процесс образования белка состоит из цепи этапов: репликация участка ДНК (или РНК), синтез РНК информационного типа, ее выход в цитоплазму клетки из ядра, соединение с рибосомой и постепенное прикрепление аминокислотных остатков, которые поставляются транспортной РНК. Вещество, что является мономером белка, участвует в ферментативной реакции отщепления гидроксильной группы и протона водорода, а затем присоединяется к наращиваемой полипетидной цепочке.
Таким образом получается полипептидная цепочка, которая уже в клеточном эндоплазматическом ретикулуме упорядочивается в некую заранее заданную структуру и дополняется углеводным или липидным остатком, если это требуется. Это называется процессом "созревания" белка, после чего тот направляется транспортной клеточной системой к месту назначения.
Функции синтезированных белков
Мономерами белков являются аминокислоты, необходимые для построения их первичной структуры. Вторичная, третичная и четвертичная структура уже образуется сама, хотя иногда также требует участия ферментов и прочих веществ. Однако они уже не являются основными, хотя и крайне необходимы, чтобы белки выполняли свою функцию.
Аминокислота, что является мономером белка, может иметь места прикрепления углеводов, металлов или витаминов. Образование третичной или четвертичной структуры дает возможность найти еще больше мест для расположения вставочных групп. Это позволяет создать из белка производное, которое играет роль фермента, рецептора, переносчика веществ в клетку или из нее, иммуноглобулина, структурного компонента мембраны или клеточной органеллы, мышечного белка.
Белки, образованные из аминокислот, являются единственной основой жизни. И сегодня считается, что жизнь как раз зародилась после появления аминокислоты и вследствие ее полимеризации. Ведь именно межмолекулярное взаимодействие белков и есть начало жизни, в том числе и разумной. Все остальные биохимические процессы, включая энергетические, нужны для реализации белкового биосинтеза, и как результат, дальнейшего продолжения жизни.